
科目: 来源: 题型:
【题目】我国明代《本草纲目》中收载药物 1892 种,其中“烧酒”条目中写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.分液B.渗析C.萃取D.蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
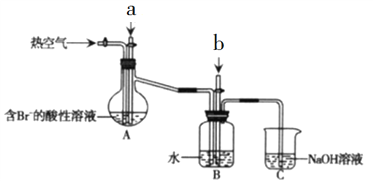
A. A装置中通入的a气体是Cl2
B. 实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C. B装置中通入b气体后发生的反应为SO2+Br2+2H2O===H2SO4+2HBr
D. C装置的作用只是吸收多余的SO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 如下图实验装置,当有16.8g铁粉参加反应时,生成的气体在标准状况下的体积是__L。
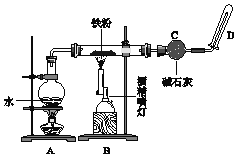
(2) 向Cu和CuO组成的混合物中,加入100mL 6.0mol·L1稀硝酸溶液,恰好使混合物完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
①原混合物中Cu和CuO的物质的量之比为______;
②假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为______mol·L1;
③若将生成的NO气体完全溶解,需要标准状况下的氧气的物质的量为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
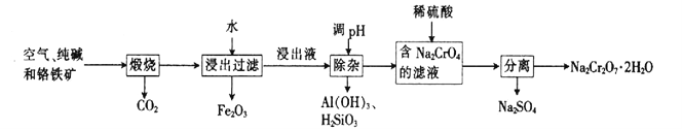
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
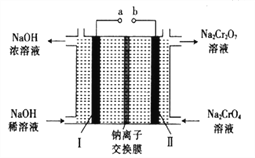
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关乙烯的下列叙述:
①乙烯溶于水后可得乙醇
②乙烯能发生加聚反应
③乙烯能与溴水发生加成反应
④乙烯是无色、稍有气味、难溶于水的气体
其中正确的是
A. 只有②B. ①和③C. ②和③D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过如图所示的路线合成:
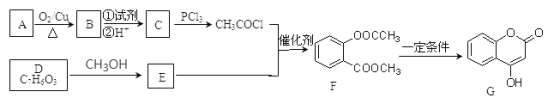
已知:①RCOOH![]() RCOCl;②D与FeCl3溶液能发生显色反应。
RCOCl;②D与FeCl3溶液能发生显色反应。
③:![]()
回答下列问题:
(1)C→H的反应类型是_______________,B→C步骤①中所加的试剂可能是_____________,D中的官能团名称为____________________。
(2)B、E的结构简式为:B:_____________,E:______________。
(3)A→B的化学方程式为_________________,G与足量NaOH溶液充分反应的化学方程式为_________________________。
(4)写出同时满足下列条件的所有E的同分异构体的结构简式________________。
①不能发生水解反应,能发生银镜反应
②该分子核磁共振氢谱有五个组峰,且峰面积之比为2:2:2:1:1
③与FeCl3溶液能发生显色反应
④苯环上有两种不同化学环境的氢原子
(5)已知:酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(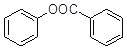 )是一种重要的有机合成中间体。试结合题中信息写出以苯酚、甲苯为原料制取该化合物合成路线流程图(其他试剂任选)______。合成路线流程图示例:
)是一种重要的有机合成中间体。试结合题中信息写出以苯酚、甲苯为原料制取该化合物合成路线流程图(其他试剂任选)______。合成路线流程图示例: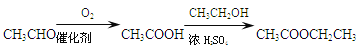
查看答案和解析>>
科目: 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
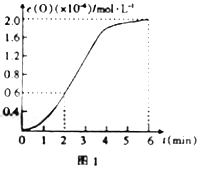
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
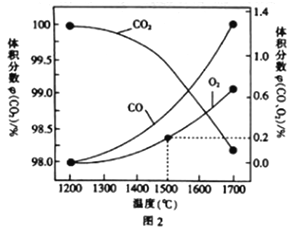
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
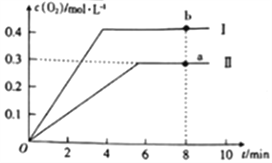
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
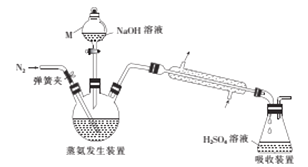
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com