
科目: 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. NH3 + HCl =NH4Cl
B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
C. H2SO4+2NaOH = Na2SO4+2H2O
D. Cl2 + H2O = HCl + HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
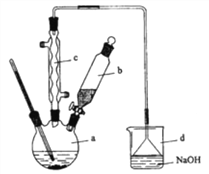
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生。请分别写出a仪器和c仪器的名称:_________________________、________________________________。
(2)请写出a中发生反应的化学方程式:___________________。d中倒置漏斗的作用是:_____,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型。试分析该同学的操作是否可行:______(填“是”或“否”),简要说明其原因:________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
经以上分离操作后,粗溴苯中还含有的主要杂质为___,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目: 来源: 题型:
【题目】用海带制备单质碘,制备过程如下:
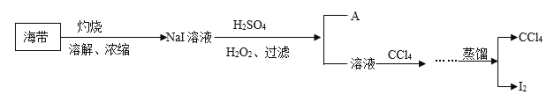
已知:常温下,碘在水中的溶解度为0.034g;碘的沸点为184℃;CCl4的沸点为77℃。
请回答:
(1)A物质是__________。
(2)写出在酸化下用H2O2氧化NaI的化学反应方程式_________________。
(3)流程中省略部分的操作是_____________。
(4)蒸馏装置中错误的是__________________(写三条)。
(5)蒸馏出的CCl4液体中常会带淡紫色,可能的原因是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】电解饱和食盐水,2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是
H2↑+Cl2↑+2NaOH 生成4mol 的NaOH,(a为饱和食盐水),下列说法正确的是
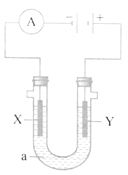
A. 在X极生成2mol Cl2 B. 在X极生成2molH2
C. 在Y极生成4mol Cl2 D. NaOH在Y极生成
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )
A.稀H2SO4
B.稀盐酸
C.K2SO4固体
D.KNO3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】查尔酮是一种重要的化工原料,可以通过如下过程合成。请回答下列有关问题:
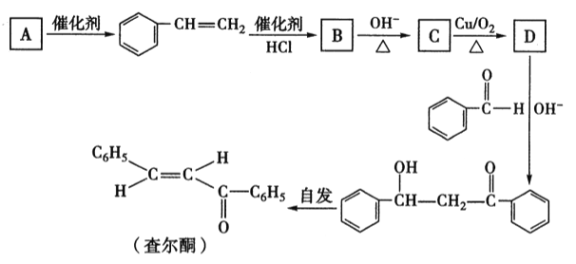
(1)已知A的分子式为C8H10,它的结构简式为_______。查尔酮的结构属于烯烃的_____ (填“顺式”或“反式”)异构。
(2) B转化成C的反应类刑属于________;C分子中含氧官能团为______。
(3)D物质在OH-存在时与苯甲醛反应的化学方程式为___________。
(4) D的同分异构体中,属于芳香醛的有_____种;其中核磁共振氢谱吸收峰种类最少的一种同分异构体的名称为________。
(5)参照上述合成路线,写出由CH3CH=CH2制取丙酮的流程图:____________。
查看答案和解析>>
科目: 来源: 题型:
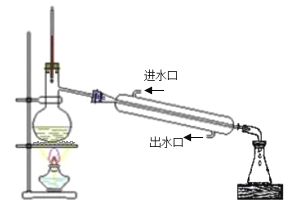
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
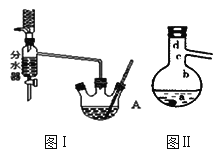
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL过量乙酸,0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)使用分水器(实验中可分离出水)能提高酯的产率,其原因是_______________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶,先后顺序是___________。(填“先a后b”或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com