
科目: 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法正确的是
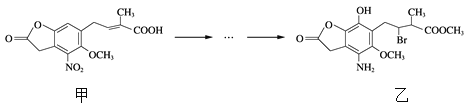
A. 甲的分子式为C14H14NO7
B. 甲、乙中各有1个手性碳原子
C. 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙
D. 乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与5 mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是
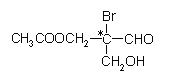
A. 催化剂作用下与H2反应
B. 与NaOH水溶液反应
C. 发生银镜反应
D. 与乙酸发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某原料药合成路线如下:
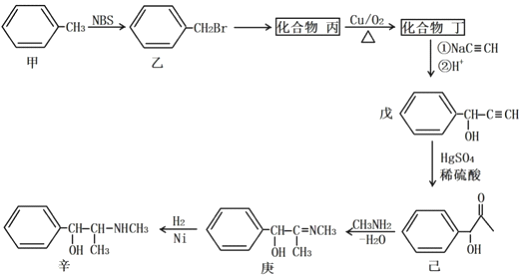
(1)甲→乙的反应类型为_______________;乙→丙的反应条件为__________________。
(2)丁的名称为______________;戊分子含的官能团的名称为______________________;己的分子式为______________________;
(3)己→庚的化学方程式为________________________。
(4)化合物己的芳香族同分异构体有多种,A和B是其中的两类,它们的结构和性质如下:
①己知A遇FeC13溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则A 的结构简式可能为_________________或_________________。
②已知B中含有甲基,能发生水解反应,苯环上只有一个取代基,则B的结构有_________种。
(5)丁烯酮(![]() )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC![]() CH) 为原料(无机试剂任选),设计制备丁烯酮的合成路线:________。合成路线流程图示例如:
CH) 为原料(无机试剂任选),设计制备丁烯酮的合成路线:________。合成路线流程图示例如:![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
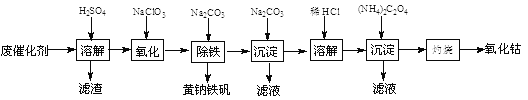
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是________。(填化学式)
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:______________________________________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是_______________________。
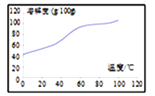
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___________________________。
(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 molL-1 Fe3+ 和0.26 molL-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+)<4×10-5 molL-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为_________________。 {KspCu(OH)2]=2.6×10-19 ;KspFe(OH)3]=4×10-38}
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置。
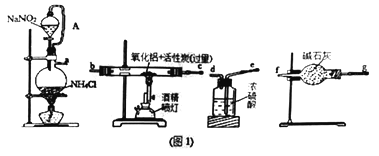
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该离子方程式为____________________。
(2)按要求连接好实验装置后,接下来首先进行的操作是______________________________。
(3)导管A的作用是_______________________________。
(4)图1装置中各仪器导管口连接的顺序是(可重复使用,用小写字母a→f填写):____
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。
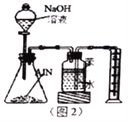
①氮化铝与过量的NaOH溶液反应生成氮气化学反应方程式为__________________________。
②集气瓶中的苯的作用是_________________________;集气瓶中的液体没有装满,则实验测得NH3的体积将___________________________(填“偏大”“偏 小”或“不变”)。
③若实验中称取氮化铝样品的质量为8.2g,测得氨气的体积2.8L(标准状况),则样品中AlN的质量分数为____________________(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂分析人员从生产车间取过氧化氢样品1.00mL于锥形瓶中,加入适量蒸馏水稀释,再用稀硫酸酸化后,逐滴加入0.10 mol·L-1的KMnO4溶液,当反应完全时,消耗KMnO4溶液25.00 mL,相关反应的化学方的程式为:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
(1)已知过氧化氢不稳定,试写出过氧化氢发生分解反应的化学方程式,并用双线桥标出电子转移的方向和数目_____________________________________________________。
(2)通过计算确定该过氧化氢样品的物质的量浓度(写出计算过程)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A.离子化合物中可能含有共价键B.氢键是一种特殊的共价键
C.I2的升华破坏了共价键D.非金属元素间不可能形成离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.2mol/L的稀硫酸250mL。
(1)1.2mol/L的稀硫酸的含义是__________(选填字母)。
A.1L水中含有1.2mol H2SO4
B.1L溶液中含有1.2mol H+
C.将117.6g硫酸溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为1.2mol/L
(2)请在下列操作步骤中填写有关的空格:
①用量筒量取_________mL的18.0mol/L的浓硫酸;
②将_______________沿烧杯内壁慢慢注入盛有少量____________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入_________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(3)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)。
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;

③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
(4)某同学取配制的1.2mol/L的稀硫酸100mL,向其中加入足量的锌粒,产生的H2在标准状况下的体积为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com