
科目: 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
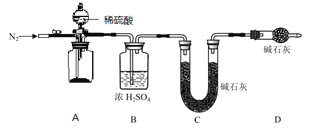
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A.SO2能使FeCl3、酸性KMnO4溶液变色或褪色B.可以用澄清石灰水来鉴别SO2与CO2
C.可将SO2通过很高的烟囱排放到大气中D.少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】现有如下微粒:
①I2 ②Br- ③Na+ ④Fe2+ ⑤H+ ⑥Fe3+
⑦Mg ⑧Cl2 ⑨HCl ⑩H2O S SO2
其中在反应中只能作还原剂的有 , 只能作氧化剂的有 , 既可作氧化剂又可作还原剂的有。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X是一种具有果香味的合成香料,如图所示为合成X的一种流程。 E是日常生活中常见的一种有机物,碳、氢的质量分数分别约为52.17% 、13.04% ,其余为氧,E的相对分子质量为46,其中含有甲基和亚甲基(—CH2—)。
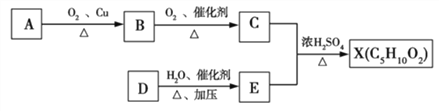
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是_____,E的结构简式是_______。
(2)D→E的化学反应类型为________。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是___。
(4)写出和E是同系物且差2个碳原子能和钠反应的所有同分异构体的结构简式_______________________________________________。
(5)反应C + E![]() X的化学方程式为____________________________。
X的化学方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________,Si原子在该层上的电子数为__________。
(2)按照构造原理, 35号元素基态原子的简化电子排布式为_______________,其核外有________个能层;最外层电子数是____________。
(3)Cu原子序数为________,其核外价层电子的排布式为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)25 ℃,两种酸的电离常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HCO![]() 的电离常数表达式K=________。
的电离常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
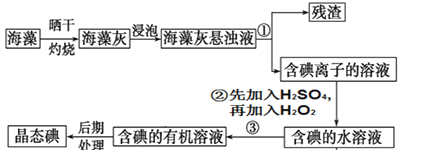
(1)指出提取碘的过程中有关的实验操作名称:
过程①____________;写出过程②中有关反应的离子方程式:
________________________________________________。
(2)灼烧海带用到的硅酸盐仪器有
__________________________________________________。
(3)过程③提取碘的过程中,可供选择的有机试剂是(____)
A.酒精 B.四氯化碳
C.甘油 D.醋酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
D.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
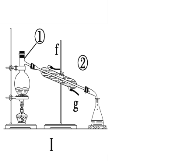
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
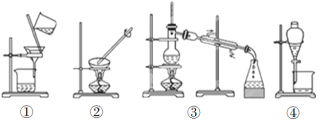
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属及其合金的说法正确的是
A.在化学反应中,金属失电子,被还原
B.合金与各组分金属相比一般具有更低的熔点
C.生铁、普通钢和不锈钢中的碳含量依次增加
D.Fe2O3是磁铁矿的主要成分,属于碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com