
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2NA
B. 1mol NaCl中所含电子总数为20NA
C. 46g NO2和N2O4的混合气体中含有的原子总数为4.5NA
D. 常温常压下,22.4L CO2中含有的CO2分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 所有自发进行的化学反应都是放热反应
B. 同一物质固、液、气三种状态的熵值相同
C. △H < 0、△S > 0的反应可自发进行
D. 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价________________________________。
请设计实验,证明丙同学的结论:______________________________________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH4+的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式__________________________________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式______________________________;加入的指示剂是_____________________,判断滴定终点的现象为_____________________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH4+含量将_____________(填“偏高”、“偏低”或“不变”)。Ⅲ. (NH4)xFey(SO4)m的化学简式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标况下5.6L的CO2质量为 _____g,其中含有______个分子,含有_____个原子;
(2)质量均为m g的 HCl、NH3、CO2、O2四种气体,所含分子数目最少的是_________,体积最大的是_____,密度最小的是_______(在相同温度和压强条件下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.ⅥA族元素中氢化物最稳定的其沸点一定最高
B.醋酸铵是含有极性键的共价化合物
C.离子化合物中不可能含有非极性共价键
D.二氯甲烷分子为正四面体结构
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因________________________________。
(2)已知:A.2NH3(g)+CO2(g)![]() NH2COONH4(l) ΔH=-123kJ/mol
NH2COONH4(l) ΔH=-123kJ/mol
B. NH2COONH4(l)![]() (NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:__________________________________。
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是_____________________;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。

(3)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=________________;保持温度不变,反应容器中每种物质各增加0.1mol,则平衡将___________移动;其他条件不变,下列措施一定可以增大氨气转化率的是_________________。
a.降低氨气浓度 b.增大容器体积 c.降低温度 d.移除水蒸气 e.选择合适的催化剂
查看答案和解析>>
科目: 来源: 题型:
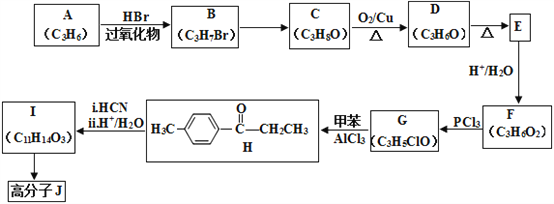
【题目】高分子合物J的合成路线如下:
已知:i. 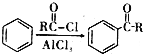
ii. 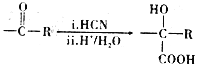
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备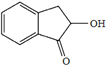 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)科学家可以通过__________法发现太阳存在有大量的铁元素,写出基态Fe原子的价电子排布图__________________。从结构上分析Fe3+比Fe2+稳定的原因:________________________。
(2)SCN-常用来检测Fe3+的存在,SCN-中心原子的杂化方式为_________,三种元素电负性由大到小的顺序为__________________。
(3)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_________(填化学式),其理由是________________________。
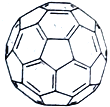
(4)C60分子又名足球烯,它是由60个碳原子组成的球状分子,右图为C60结构图。一个C60分子中六元环的数目为____________,在C60晶胞中C60分子的配位数为___________。已知C60分子的球体 半径为a nm,求C60晶体的ρ=_________g/cm3。(用NA表示阿伏加德罗常数,写出表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com