
科目: 来源: 题型:
【题目】写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是大气污染物,利用SO2→CaSO4→CaS转化可实现变废为宝。
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g)△H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s)△H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:_____________。
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g)![]() 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:

①该反应的△H__________0(填“>”或“<”,下同);图中M、N两点的平衡常数:KM_____KN。
②M点时的化学平衡常数K=____________。
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+)的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:

①图中a=_____________。
②该温度下,Ksp(CaSO4)=________________。
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为_____________________________。

(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。______

查看答案和解析>>
科目: 来源: 题型:
【题目】下列各种离子一定能大量共存的是
A. 强碱性溶液中:Na+、K+、AlO2-、CO32—
B. 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+
C. pH=7的溶液中:NH4+、Al3+、SO42—、CO32—
D. c(OH-)=1×10-13mol/L的溶液中:K+、Fe2+、Cl-、NO3—
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用工厂度弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3等)设计回收镁的工艺流程如下:

(1)酸浸过程中采用“粉碎废料、加热、搅拌、适当提高稀硫酸的浓度等”措施的目的是____________。为了提高产品的纯度,试剂X宜选择_______(填选项字母)。
A.CuO B.MgO C.MgCO3 D.氨水
(2)滤渣2的主要成分是__________(填化学式)。
(3)写出生成滤渣3的离子方程式:_______________________。
(4)已知:298K时,Ksp[Al(OH)3]=3.0×10-34、Ksp[Fe(OH)3]=4.0×10-38。
①加入试剂X,当Al3+开始沉淀时,滤液1中![]() =____________。
=____________。
②向浓度均为0.1mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。在图中面出生成Al(OH)3的物质的量与滴加NaOH溶液体积的关系图(大致图)。______

(5)若废料中镁元素的质量分数为a%,取mkg废料按上述流程生产,最终回收到20kg纯度为6%的镁锭,则镁的产率为__________(用含a、b、m的代数式表示)。
(6)参照上述流程图,设计经三步,由滤渣3得到镁锭的路线:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,恒容密闭容器中进行的可逆反应H2(g) + I2(g)![]() 2HI(g),达到平衡状态的标志是
2HI(g),达到平衡状态的标志是
A. 单位时间内消耗a mol H2,同时生成2a mol HI
B. 混合气体的平均摩尔质量不再变化
C. H2、I2、HI的物质的量之比为1:1:2
D. 混合气体的颜色不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
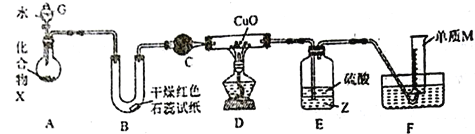
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-1gc。常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。下列说法正确( )
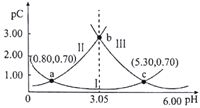
A. 曲线Ⅱ表示pC(HA-)随pH的变化
B. 当pH=1.40时,c(H2A)>c(A2-)>c(HA-)
C. 常温下,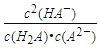 =104.50
=104.50
D. a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com