
科目: 来源: 题型:
【题目】粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:
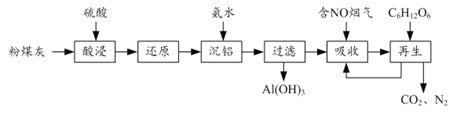
(1)①“酸浸”时Al2O3发生反应的离子方程式为______。
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是______。
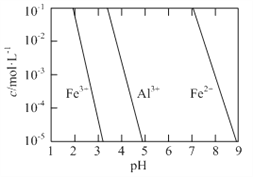
(2)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是______。
(3)沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO![]() [Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
[Fe(NO)2]2+,烟气中O2的体积分数对NO吸收率的影响如图所示。
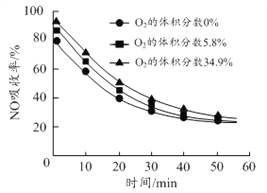
①为提高烟气中NO 的吸收率,可采取的措施有______(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为______。
(4)Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。

①该装置工作时,电极A作______极。
②熔融粗铝时加入铜的作用是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
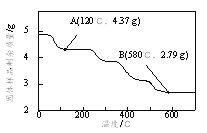
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①R—NO2![]() R—NH2;71~50)下
R—NH2;71~50)下
②![]() +H2O;
+H2O;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯为原料制备某些化合物的转化关系图:
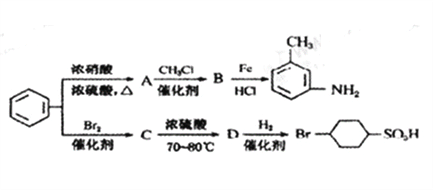
(1)A转化为B的化学方程式是_________________________。
(2)在“![]() ”的所有反应中属于取代反应的是_______(填字母),属于加成反应的是__________(填字母)。
”的所有反应中属于取代反应的是_______(填字母),属于加成反应的是__________(填字母)。
(3)B中苯环上的二氯代物有____种同分异构体。
查看答案和解析>>
科目: 来源: 题型:
【题目】某些物质的有关数据如下表,回答以下问题:
熔点(℃) | 沸点(℃) | 水溶性 | Ka1 | Ka2 | |||
乙醇 | -114.1 | 78.3 | 易溶 | 乙醇 | 2.6×10-16 | ||
乙醛 | -121 | 20.8 | 易溶 | H2SO3 | 1.23×10-2 | 5.6×10-8 | |
乙酸乙酯 | -83 | 77.0 | 难容 | H2CO3 | 4.2×10-7 | 5.6×10-11 |
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:CH3CHO+NaHSO3![]()
![]() (a-羟基乙磺酸钠)
(a-羟基乙磺酸钠)
(2)写出Na2CO3溶液参与反应的化学方程式:________________;
(3)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
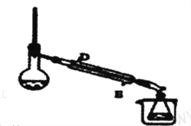
①冷凝管中的液体应从_____口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_____。(填字母)
a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验试管 | pH | ||
第一次 | 第二次 | 第三次 | |
A | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(4)试管a中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
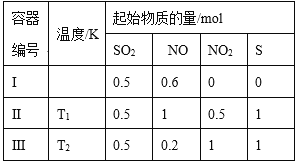
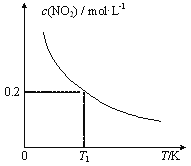
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目: 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+,跟强碱反应时生成BeO22—。现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图像正确的是( )

A. ⑤③① B. ②③④ C. ③⑤④ D. ③②①
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯产量是衡量一个国家石油化工水平的主耍标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
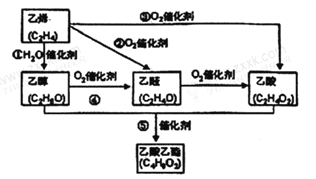
请回答下列问题:
(1)反应①的化学方程式为___________________。
(2)乙醇的同分异构体的结构简式为_____________;若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为____________________。
(3)若C4H8O2是一种由甲酸形成的酯,写出其中一种与氢氧化钠溶液反应的化学方程式为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com