
科目: 来源: 题型:
【题目】在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度②升高温度③增大压强④加入催化剂
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用软锰矿浆(软锰矿的主要成分是MnO2,还含有硅、铁、铝、钙、镁和少量重金属镍的化合物等杂质)为原料制取电解锰和四氧化三锰。

注:过量的软锰矿将Fe2+氧化为Fe3+。
(1)纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为_______。
(2)已知:Kp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,加入NH3·H2O后,Al3+浓度为l×10-6mol/L时,溶液中Fe3+浓度为_________
(3)pH对除镍效果的影响如图1:

控制pH为4.5~5.0除镍效果最好,原因是__________
(4)电解MnSO4溶液制备电解锰,用惰性电极电解,阳极的电极反应式为________,为保证电解的顺利进行,电解液必须保持一定的Mn2+浓度。Mn2+浓度和电流效率的关系如图2所示。由图可知当Mn2+浓度大于22g/L时,电流效率随Mn2+浓度增大反而下降,其原因是________。

(5)MnSO4溶液制备四氧化三锰。氨水作沉淀剂,沉淀被空气氧化所得产品的X射线图见图3。
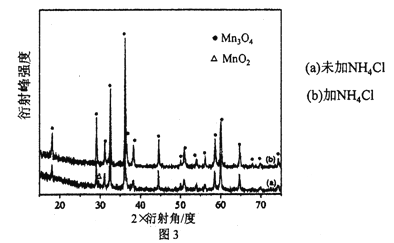
Mn2+形成Mn(OH)2时产生少量Mn2(OH)2SO4,加入NH4Cl会影响Mn2(OH)2SO4的氧化产物,写出NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用
B. CH3Clg)+Cl2(g)![]() CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H<0
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H<0
C. 在恒温密闭容器中发生反应PCl3(g)+Cl2(g)![]() PCl5(s),当PCl3的体积分数不变时,反应达到平衡状态
PCl5(s),当PCl3的体积分数不变时,反应达到平衡状态
D. 常温下pH=3的盐酸与pH=11的Ba(OH)2溶液等体积混合,溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A. 盐酸与石灰石反应CO32-+H+===CO2![]() +H2O
+H2O
B. 硫酸铜溶液中滴加氢氧化钡溶液Ba2++SO42-===BaSO4![]()
C. 氢氧化镁和盐酸反应:H++OH-===H2O
D. 氧化铁粉末溶于稀盐酸:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组按如图所示实验流程比较浓硝酸和稀硝酸的氧化性强弱,其中B为一种紫红色金属,C为红棕色气体。

请回答下列问题:
(1)A与B反应的化学方程式是___________________________________;A与B反应迅速,实验中需要采取措施控制气体放出的快慢及多少,则装置Ⅰ可以选择的装置为________。

(2)实验时在装置Ⅰ中加入B后,在加入A之前需向整套装置中通入足量的CO2气体,该操作的目的是______。
(3)装置Ⅱ中发生反应的化学方程式是_________________________。
(4)通过实验可得出:浓硝酸的氧化性比稀硝酸______(填“强”或“弱”),判断的依据是_________。
(5)小组内有同学指出该流程中装置Ⅴ可有可无,你认为装置Ⅴ是否需要___ (填“是”或“否”),理由是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三个体积相同的密闭容器,按下图所示投料,并在T℃条件下开始反应,其中容器I保持恒压100kPa。已知:分压=总压×物质的量分数,对于2NO2(g)![]() N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是
N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是

A. 达平衡时,容器Ⅱ中N2O4转化率小于50%
B. 达平衡时,容器Ⅰ中N2O4分压比容器Ⅲ中的大
C. 达平衡时,容器Ⅰ中N2O4的体积分数比容器Ⅱ中的大
D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】元素化合物的知识在社会生产、生活、环境中都有很大的应用。A、B、C、D、E均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是一种碱性气体,D是一种红棕色气体,据此回答下列问题:
①C、D两种化合物能引起的环境问题是_____________________。
A.光化学烟雾 B.能源短缺 C.酸雨 D.温室效应
②C是大气污染物之一。目前,有一种治理方法是在400℃左右、有催化剂存在的情况下,用B把C还原为A和水,则该反应的化学方程式是______________________________
每有10 mol A生成,转移电子的物质的量为________。
③实验室制取B的化学方程式是_________________________________。
(2)若B是一种臭鸡蛋气味的气体,A是一种淡黄色的固体单质,E是工业生产中一种重要的化合物,据此回答下列问题:
①B和C可以发生反应生成A,写出该反应的化学方程式:_________________。
②金属铜投入E的稀溶液中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com