
科目: 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】
化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
(1)磷酸是三元中强酸,将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是_________.直链多聚磷酸常用于制取阻燃剂
(2)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 ___NH3(填“<”或“>”或“=”);稳定性:PH3 __NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与______(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是_____________.
(3)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10﹣20.计算可逆反应AgCl(s)+2NH3(aq)Ag(NH3)2+(aq)+Cl﹣(aq)的化学平衡常数K=________(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl____mol(保留2位有效数字).
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
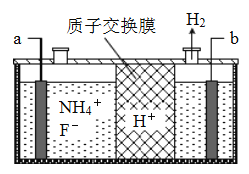
a电极为电解池的___(填“阴”或“阳”)极,其电极反应式为____________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体 (H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4 = CO2↑+CO↑+H2O 某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的 CO 气体,并用生成的 CO 气体还原 FexOy 制取铁粉。

(1)装置 B 的作用是_____。装置 E 中的现象是_________。装置 F 的作用是_________。
(2)装置 D 中玻璃管中发生反应的化学方程式为_____。
(3)若 FexOy 为 0.4g,生成的气体与过量澄清石灰水反应生成 0.75g 白色沉淀,则 FexOy 的化学式为_____。
(4)在实验开始时,点燃A、D 酒精灯的先后顺序是_____,实验完毕后,熄灭A、 D酒精灯的先后顺序是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有一定量烧碱溶液的烧杯中通入一定量的CO2 气体后,再向所得溶液中逐滴加入盐酸至过量,产生的 CO2 气体与加入 HCl 的物质的量的关系如下图所示(忽略 CO2 的溶解和 HCl的挥发):

请问图中O点对应溶液的溶质为_____(填化学式),其物质的量之比为_____。开始产生 CO2 气体时对应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com