
科目: 来源: 题型:
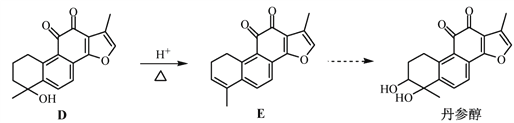
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
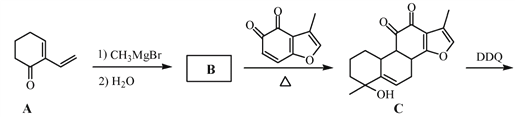
已知:![]()
(1)A中的官能团名称为__________________(写两种)。
(2)D![]() E的反应类型为__________________。
E的反应类型为__________________。
(3)B的分子式为C9H14O,写出B的结构简式:__________________。
(4)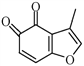 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以![]() 和
和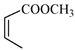 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】水热法制备直径为1---100 nm的颗粒Y(化合物),反应原理为:![]() a
a![]() 下列说法中不正确的是
下列说法中不正确的是
A.a=4 B.将Y均匀分散到水中形成的体系具有丁达尔效应
C. ![]() 是还原剂 D. 每有3 mol
是还原剂 D. 每有3 mol ![]() 参加反应,反应中转移的电子总数为5 mol
参加反应,反应中转移的电子总数为5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨反应:3H2+N2![]() 2NH3在密闭容器中进行。下列有关说法正确的是( )
2NH3在密闭容器中进行。下列有关说法正确的是( )
A. 达到化学平衡时,各物质的浓度不再改变
B. 其他条件不变,升高温度,不能增大反应的速率
C. 使用催化剂可使H2的转化率达到100%
D. 其他条件不变,降低N2的浓度,可以增大反应的速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属冶炼的说法正确的是
A. 工业上常用电解NaCl水溶液可制取金属钠
B. 工业上常用电解MgO熔融可制取金属镁
C. 工业上常用CO高温条件下还原Fe2O3可制取Fe
D. 工业上常用金属钠和TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目: 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
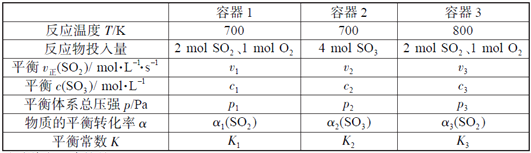
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

回答下列问题:
(1)题中通入CO2后所得溶液的溶质成分为______________,若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_____。
(2)原NaOH溶液的物质的量浓度为 _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. MgCl2的摩尔质量为95g
B. 18g H2O含有的原子总数为3NA
C. 0.5mol H2所占体积约为11.2L
D. 0.1 mol·L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×102,Ka2 (H2C2O4 ) =5.4×105,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4) +c(C2O42)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A. 0.1000 mol·L1 H2C2O4溶液:c(H+ ) =0.1000 mol·L1+c(C2O42 )+c(OH)c(H2C2O4 )
B. c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42 ) >c(H+ )
C. pH = 7的溶液:c(Na+ ) =0.1000 mol·L1+ c(C2O42) c(H2C2O4)
D. c(Na+ ) =2c(总)的溶液:c(OH) c(H+) = 2c(H2C2O4) +c(HC2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com