
科目: 来源: 题型:
【题目】2019年世界地球日宣传主题为“珍爱美丽地球 守护自然资源”。下列做法不符合这一主题的是
A. 超量开采稀土资源,满足全球市场供应
B. 推广清洁能源汽车,构建绿色交通体系
C. 合理处理废旧电池,进行资源化再利用
D. 科学施用化肥农药,避免大气和水污染
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3-CH2=CHCH3可简写为![]() 。某有机物X的键线式为:
。某有机物X的键线式为: 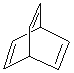
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式。____________。
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式:_______________________。
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的二氯代物有_____种。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)等温、等压下,等体积的O2和O3所含分子个数比______,质量比为_______。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_____。
(3)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)分别用p(Ne)、p(H2)、p(O2)表示,由大到小的顺序是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为焦炭,则丁可能是O2 B. 若甲为SO2,则丁可能是氨水
C. 若甲为Fe,则丁可能是盐酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
①H2O2 + I-![]() H2O + IO-慢
H2O + IO-慢
②H2O2 + IO-![]() H2O + O2 + I- 快
H2O + O2 + I- 快
下列说法不正确的是
A. ν(H2O2) =ν(H2O) =ν(O2) B. 反应的速率与I-浓度有关
C. I-是该反应的催化剂 D. 反应①活化能大于反应②的活化能
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的3p能级上有两个未成对电子,因此其 ( )
A. 第三电子层上有4个电子B. 最高正价为+2
C. 最高正价为+4D. 第二电子层没有未成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.空白实验分析是化学实验中常用的一种方法,是指在不加样品的情况下,用与测定样品相同的方法、步骤进行定量分析,把所得结果作为空白值,从样品的分析结果中扣除,这样可以消除由于试剂不纯或试剂干扰等所造成的系统误差。
“凯氏定氮法”是经典的测定化合物或混合物中总氮量的一种方法。某化学实验小组成员想通过“凯氏定氮法”实验测定某品牌化肥中的氮含量。

实验流程如下:
步骤:①取10.00g化肥样品溶于水,定容至100mL;
②在烧杯中加入10.00mL步骤①中得到化肥水溶液和辅助试剂,加热使其充分反应;
③反应完毕,将反应液转移到大试管中;
④按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);

⑤取下锥形瓶,滴加指示剂,用0.2500mol·L-1盐酸标准液滴定;
⑥重复实验操作。
数据记录如下:
实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
1 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.18 |
2 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.70 |
3 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.22 |
4 | x |
请回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______________;H3BO3为一元弱酸,在水中发生反应H3BO3+H2O![]() [B(OH)4]-+H+。室温下,pH相同的硼酸溶液、盐酸中,水的电离程度__________(填“前者大”、“后者大”或“相同”);
[B(OH)4]-+H+。室温下,pH相同的硼酸溶液、盐酸中,水的电离程度__________(填“前者大”、“后者大”或“相同”);
(2)步骤④的实验装置中需要加热的仪器是___________(填仪器名称),长导管的作用是______________;
(3)编号为4的实验应加入的样品和辅助试剂为__________________________;
(4)计算该化肥中的氮含量为____克/每千克化肥(含x代数式表示,要求化简)。
Ⅱ.假设实验分析法也是化学实验常用的方法,以下实验研究影响化学反应速率的因素。
(1)已知KHSO3与KIO3反应的离子方程式为IO3-+3HSO3-==3SO42-+I-+3H+;一定量的KHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段速率突然增大。对其原因提出如下假设,请完成假设2。
假设1:生成的SO42-对反应起催化作用;
假设2:___________________________;
(2)请设计实验验证上述假设1,完成下表中内容。
实验步骤 | 预期实验现象和结论 |
在烧杯甲中将一定量的KHSO3溶液与KIO3溶液混合,用速率检测仪测定起始阶段速率v(甲); 在烧杯乙中先加入少量______(填试剂),其他条件与甲完全相同,用速率检测仪测定起始阶段速率v(乙)。 | 若v(甲)< (乙),则假设1成立 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机反应中间体(M)的一种合成路线如图所示。



③标准状况下,气态烃A的密度是H2的14倍
④芳香族化合物H能发生银镜反应
请回答下列问题:
(1)B的名称(系统命名)为_____________ ;H→I的反应类型为___________;
(2)J中官能团的名称为_________,
(3)G→H的化学方程式为____________________________________________;
(4)D+J→M的化学方程式为__________________________________________;
(5)写出符合下列条件的J的所有同分异构体的结构简式________(不考虑立体异构)。
①苯环上连有-NO2 ②核磁共振氢谱有3个峰
符合以上条件的J的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是__________________(填选项字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪
(6)结合已有知识和相关信息,写出以CH3CHO和E为原料,经三步制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例为:
的合成路线流程图(无机试剂任用)。合成路线流程图示例为: _____________
_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)写出D在元素周期表中的位置为___________________ ,其三价阳离子的价层电子排布图为___________________ ;
(2)F元素位于元素周期表_________区,其基态原子有_________种能量不同的电子;
(3)第二周期中基态原子未成对电子数与E相同且电负性较大的元素为___________(写元素符号);
(4)E单质可作邻硝基苯酚或对硝基苯酚与H2加成的催化剂。邻硝基苯酚和对硝基苯酚在20![]() 水中的溶解度之比为0.39,其原因为___________________;
水中的溶解度之比为0.39,其原因为___________________;
(5)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。黄血盐的内界是_____(写出化学式),黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与黄血盐的配体互为等电子体的气态化合物,写出该气态化合物的电子式__________;
(6)E2+与Mg2+、O2﹣形成晶体的晶胞结构如下左图所示(E2+未画出),则该晶体的化学式为__.


(7)金属C、F晶体的晶胞结构如上图Ⅰ、Ⅱ(请先判断对应的图),金属F的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA, F原子的摩尔质量为M g/mol,则表示F原子半径的计算式为______________pm(列出算式即可,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是

A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com