
科目: 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液: K+、Al3+、Cl-、SO42-
B. 含有大量NH4+的溶液: Na+、S2-、OH-、NO3-
C. 通有足量NO2的溶液: K+、Na+、SO42-、AlO2-
D. 强酸性溶液: Na+、Fe3+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4=_________kJ·mol-1。
H2O(g)的ΔH4=_________kJ·mol-1。
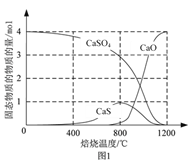
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为___________;高于800 ℃时主要发生的反应的化学方程式为___________。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是___________;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___________。

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___________。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液能用来区分SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③溴水 ④酸性高锰酸钾溶液 ⑤品红溶液
A. ③⑤ B. ②③⑤ C. ②③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化) ( ).
A.①B.①④⑤C.①③⑤D.①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:
Ni(OH)2+5CH3NC=(CH3NC)4Ni +CH3NCO+H2O
⑴Ni2+基态核外电子排布式为___________。
⑵CH3NC(其结构简式为![]() )分子中碳原子轨道的杂化类型是___________;
)分子中碳原子轨道的杂化类型是___________;
 1 molCH3NC中σ键的数目为___________。
1 molCH3NC中σ键的数目为___________。
⑶用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___________。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___________。
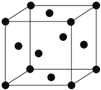
⑷Ni单质的晶胞结构如右图所示,每个晶胞中含Ni原子数目为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是合成抗过敏药喘乐氧蒽酸的中间体,可通过以下方法合成:

⑴化合物E中的含氧官能团名称为___________。
⑵B→C的反应类型为___________。
⑶D经还原得到E。D的分子式为C14H9O5N,写出D的结构简式___________。
⑷写出同时满足下列条件的F的一种同分异构体的结构简式:___________。
①分子中含有两个苯环;②能发生水解反应生成两种物质,其中一种能与FeCl3溶液发生显色反应,另一种能发生银镜反应;③分子中只有3种不同化学环境的氢。
⑸已知:Na2Cr2O7不能氧化![]() (—R为烃基)。
(—R为烃基)。
请以 和CH3OH为原料制备
和CH3OH为原料制备![]() ,写出合成路线流程图(无机试剂可任选)。________合成路线流程图示例如下:
,写出合成路线流程图(无机试剂可任选)。________合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的
CH3OH(g) △H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的
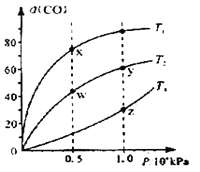
A. 混合气体密度:ρ(x)=ρ(w)
B. 正反应速率:υ正(y)=υ正(w)
C. 反应温度:T1>T2
D. 混合气体平均摩尔质量:M(y)<M(Z)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是

A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D. 加水稀释H点对应的溶液,溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com