
科目: 来源: 题型:
【题目】下列操作中不正确的是
A.过滤时,玻璃棒与三层滤纸的一边接触
B.过滤时,漏斗下端紧贴烧杯内壁
C.加热试管内物质时,试管底部与酒精灯灯芯接触
D.向试管中加水时,胶头滴管不能紧贴试管内壁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A. O2和O3互为同素异形体
B. 12C和14C互为同位素
C. CH3CH2OH和CH3OCH3互为同分异构体
D. CH3COOCH3和HCOOCH2CH3为同一种物质
查看答案和解析>>
科目: 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
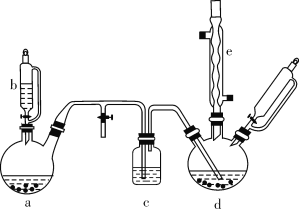
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L1 HA中逐滴加入0.1 mol·L1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
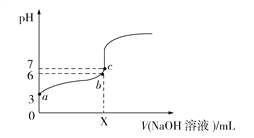
A. b点溶液中H2O电离出的H+浓度大于c点
B. Ka(HA)=106
C. b点溶液中有c(A)c(Na+)=9.9×107 mol·L1
D. c点溶液中的微粒只有A、OH、H+、Na+和H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在反应C(s)+CO2(g)2CO(g)中,可使反应速率明显增大的措施是:①降低压强;②升高温度;③增大CO2的浓度;④增加碳的量;⑤增大压强( )
A.①②③B.②③④C.①②③④D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是

A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com