
科目: 来源: 题型:
【题目】下列方法中,不能用于实验室里制取氨气的是
A. 在试管中将熟石灰和氯化铵混合后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A.鉴别碳酸钠和碳酸钾可以通过焰色反应实验,焰色反应属于化学变化
B.钠投入到饱和石灰水中有金属钙被还原出来
C.铝的化学性质本不活泼,难被腐蚀
D.铝制容器不宜长时间存放酸性、碱性或咸的食物
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用干海带浸取原液制取纯碘主要包含的步骤有:①通氯气氧化、②用CCl4萃取分液、③在CCl4相中加入NaOH溶液反萃取(转化为NaI和NaIO3)并分液、④水相用硫酸酸化分离出粗碘、
⑤干燥后加适量KI固体(将IBr和ICl转化为I2、KBr及KCl)混匀加热得纯碘等。选择下列装置进行实验:
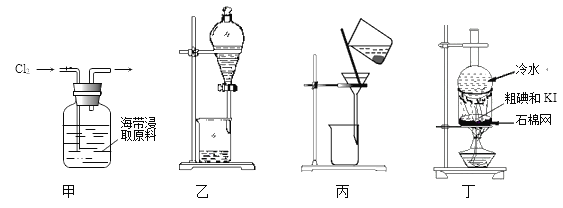
下列说法错误的是
A. 步骤①可用甲装置氧化I-
B. 步骤②、③分液操作时可用乙装置:先放出有机相,再放出水相
C. 步骤④可用丙装置将碘与母液分离
D. 步骤⑤可用丁装置升华法提纯碘
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性
B. 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
D. 油脂在碱性条件下水解,可用于制硬化油
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为___________。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中):
①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式_____________。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00ml,判断达到滴定终点的方法是_________。该水样中ClO2的浓度是___mg/L。
(3)某学习小组设计如下装置进行制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式为_______。将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。
②装置B的作用是____________。
③某同学认为上述装置并不完整,请画出需补充的装置图____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质加入水中或与水发生反应后,溶液温度降低的是( )
A. 生石灰与水反应 B. 氢氧化钠固体加入水中
C. 浓硫酸加入水中 D. 硝酸铵晶体加入水中
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的![]() ,则下列说法中不正确的是
,则下列说法中不正确的是
![]()
A. 原子半径由大到小排列顺序Z>Y>X
B. Y元素的两种同素异形体在常温下都是气体
C. 最高价氧化物对应水化物的酸性W>Z
D. 阴离子半径由大到小排列顺序Z>W>X>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次
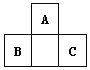
A. Be、Na、AlB. B、Mg、SiC. O、P、ClD. C、Al、P
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 元素的种类由核外电子数决定
B. 原子的种类由原子核内质子数与中子数共同决定
C. 核外电子排布相同的两个原子一定是同种原子
D. 某元素的原子核内有m 个质子,n 个中子,则该元素的相对原子质量为m + n
查看答案和解析>>
科目: 来源: 题型:
【题目】采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建没。
(1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4.Ca(NO3)2的副产品,工业流程如题20图一l所示。

①反应釜I采用“气一液逆流”接触吸收法(如题20图-2),其优点是________________。
②反应釜Il中CaSO3转化为CaSO4的化学反应方程式为 ___________________________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。

① 由图I知,当废气中的NO含量增加时,宜选用______法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为________。
(4)研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率下降的原因为__________。
②写出废气中的SO2与NaC1O2反应的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com