
科目: 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D原子序数依次递增的短周期主族元素,常温常压下AB2是一种红棕色气体,B与C同主族,则:
(1)C元素在周期表中的位置____________。
(2)画出D元素的简单离子结构示意图_______________________。
(3)将CB2与D2以体积比1:1混合后通入品红溶液中,品红溶液不褪色,请用一个化学方程式来解释:_________________________________。
(4)AB2与水反应的化学方程式为___________,在一定温度和压强下,将一个容积为15mL的试管充满AB2后,倒置于一个盛水的水槽中,当试管液面上升至一定高度不再变化时,相同条件下再通入O2,若要使试管液面仍保持在原高度,则应通入的O2为___________mL。
(5)甲、乙、丙均为含A元素的化合物,丁为单质,甲、乙、丙、丁四种物质有如下转化关系(反应条件及部分产物已略去)
![]()
①若丁为一种常见的非金属单质,甲为氢化物,乙为氧化物,则一个乙分子所含有的电子数目___________。
②若丁为一种常见的金属单质,常温下丁在甲的浓溶液中能反应但很快停止,则丙的化学式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能与新制氢氧化铜悬浊液反应
B. 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯
C. 在酸性条件下,CH3CO18OC2H5的水解产物是 CH3CO18OH和CH3OH
D. 甘氨酸和盐酸的化学方程式是NH2-CH2-COOH+HCl![]() HOOC-CH2-NH3+Cl-
HOOC-CH2-NH3+Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
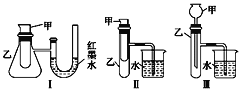
(1)上述3个装置中,不能证明“铜与浓硝 酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入 适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是______________,说明该反应属于_____ (填“吸热”或“放热”)反应。
(3)为定量测定(2)中反应的反应热,使50 mL 0.50 mol·L-1盐酸与50 mL0.55 mol·L-1NaOH溶液在简易量热计中进行中和反应.回答下列问题:
①该实验中NaOH的浓度大于HCl的浓度的作用是_________________________。
②实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 | C—H | C—F | H—F | F—F |
键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-![]() D+E,据此回答下列问题:
D+E,据此回答下列问题:
(1)写出D的结构式___________,E的结构式___________。
(2)实验室制备D物质的反应方程式________。
(3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。
(4)B、F两元素组成的原子数目比为1:1的化合物的电子式___________、该物质中存在的化学键有__。
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
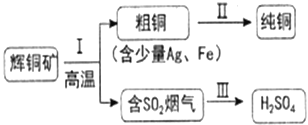
(1)Cu2S中Cu元素的化合价是__________价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的_________极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是__________________________。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
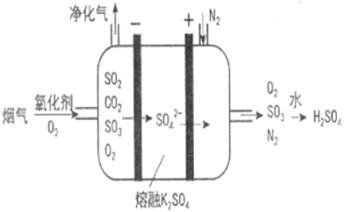
①在阴极放电的物质________________。
②在阳极生成SO3的电极反应式是_______________________________。
(4)检测烟气中SO2脱除率的步骤如下:
(i).将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
(ii)加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
(iii)过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示(i)中溴水的主要作用________________________________。
②若沉淀的质量越大,说明SO2的脱除率越________(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如下:
合成反应:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环已烯10g。
请回答下列问题:
(1)装置b的名称是_________________。
(2)加入碎瓷片的作用是__________________,如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是(填正确答案标号)__________。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______________。
(4)分液漏斗在使用前须清洗干净并___________;在本实验分离过程中,产物应该从分液漏斗的__________(填“上口倒出”或“下口放出”)
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.玻璃棒 D.锥形瓶
(7)本实验所得到的环已烯产率是有________(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。
②乙组实验中发生反应的离子方程式为_________________________________。
③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。
(2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。

①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”);
②a=__________ mL。
③c(Na+)=c(CH3COO-)的点是_____________。
④E点对应离子浓度由大到小的顺序为_________________。
(3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列贮存试剂的方法错误的是
A. FeCl3溶液加入少量铁粉保存 B. 常温下,浓硝酸保存在铁器皿中
C. 烧碱溶液保存在带橡胶塞的试剂瓶中 D. 小块钠保存在煤油中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com