
科目: 来源: 题型:
【题目】两份等质量Na2O2和NaHCO3均匀混和物,向其中一份加入100mL盐酸,充分反应呈中性,放出气体经干燥后测得体积为2.24L(标准状况)。如将该气体通入另一混和物中充分反应后,气体体积变为2.016L(标准状况)。若混合物中NaHCO3的物质的量大于Na2O2。则:
(1)原混和物中Na2O2与NaHCO3的物质的量之比为__________________;
(2)加入盐酸的物质的量的浓度为_____________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:(A、B均为气体)
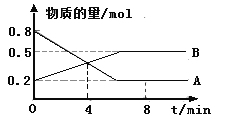
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ;
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(2)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
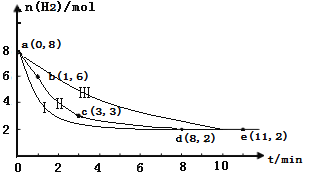
①a—b,b—c,c—d,d—e四段中,平均反应速率最大的时间段是___________ ,该时间段内CO2的平均反应速率是________。
②若在反应中加入了催化剂,则反应过程将变为图中的曲线_____ (填“Ⅰ”或“Ⅱ”或“Ⅲ”)。
③平衡时CO2的转化率是_________;反应前后容器内的压强比是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙,化学式为CaO2,微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。现有一种制备过氧化钙的实验方案,流程如下图,其主要反应的化学方程式为:CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O表示。回答下列问题:
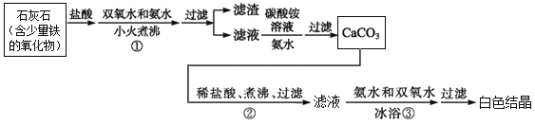
(1)步骤①中,加入氨水的目的是_____________,小火煮沸的作用是________________________。
(2)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体;再将溶液煮沸,趁热过滤。此过程中,将溶液煮沸的作用是________________________________________。
(3)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到产品。此法工艺简单、操作方便,但是得到的产品纯度较低,往往CaCO3、Ca(OH)2等杂质含量较高。若实验室只提供稀盐酸和澄清石灰水两瓶试剂,以及试管、小烧杯、胶头滴管、药匙各1个,请设计实验检验所得产品中含有CaCO3。_____________________________(简要描述方案即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。

(3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。

(4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:

①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。
②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
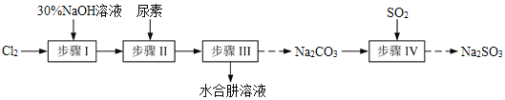
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
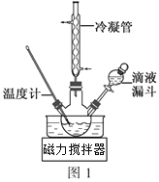
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
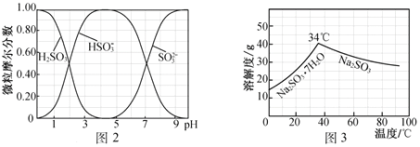
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_________________________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
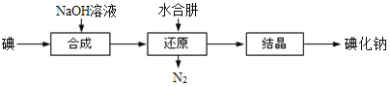
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用胶体的知识解释的现象是
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3 的稀溶液呈黄色,回答下列问题:
(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。锗与Z是同一主族元素,它可用来制造半导体晶体管。研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有 H2O2 存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________
(3)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2 固体得到___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com