
科目: 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
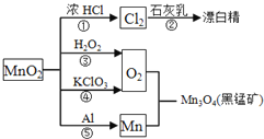
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
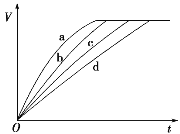
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目: 来源: 题型:
【题目】(8分)A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。

请回答下列问题:
(1)写出A和C的名称或化学式: A ,C ;
(2)在上图D→C的过程中,D表现出强 (填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质含有的化学键类型完全相同的是:
A. NaOH、CaCl2、CaO B. Na2O、Na2O2、Na2S
C. NaCl、HCl、H2O D. HBr、CO2、NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·molˉ1
②N2(g)+O2(g)![]() 2NO(g) ΔH2
2NO(g) ΔH2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
4N2(g)+6H2O(g) ΔH3=-1625.5 kJ·molˉ1。
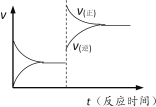
下列说法正确的是
A. 反应①使用催化剂,ΔH1减小
B. 反应②生成物总能量低于反应物总能量
C. 反应③一定能自发进行
D. 反应③达到平衡后升高温度,v(正)、v(逆)的变化如右图所示
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,溶液中由水电离出氢离子的浓度为1×10-12mol·L-1,下列说法正确的是( )
A.该溶液pH=12B.该溶液pH=2
C.该溶液pH=12或2D.不能确定溶液pH
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2NO2—+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
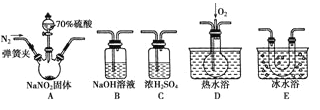
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、______、______。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________ 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________________________。
②装置E的作用是________________________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_______________________。
如果没有装置C,对实验结论造成的影响是__________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末,其中含有SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质。二氧化铈(CeO2)是一种重要的稀土氧化物,某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)第①步反应的化学方程式是___________________________________________________,
检验滤渣A是否洗净的方法是____________________________________________________。
(2)第②步反应的离子方程式是___________________________________________________。
(3)萃取是分离稀土元素的常用方法,化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来。实验室进行萃取操作需要用到分液漏斗,分液漏斗在使用前需要进行的操作是________;TBP是一种磷酸三丁酯,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(4)取上述流程中得到的Ce(OH)4产品0.5 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com