
科目: 来源: 题型:
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中不正确的是

A. 实验前pH(Na2CO3)>pH(NaHCO3)
B. 实验后两溶液中离子种类完全相同
C. Na2CO3溶液中生成的沉淀比NaHCO3溶液中生成的沉淀多
D. 两溶液中反应的基本类型相同
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】A1-MnO4电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。已知电池总反应为Al + MnO4 ═AlO2- + MnO2.下列说法正确的是( )

A. 电池工作时,K+向负极移动
B. 电池工作时,电子由Al经电解质溶液流向Ni
C. 负极反应为Al- 3e + 4OH ═AlO2 + 2H2O
D. 电池工作时,Ni电极周围溶液pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 1mol联氨(N2H4)中含有5mol共价键
C. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:________________________。
②每生成1 mol FeO42-转移________ mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因是________________________________________________________________。
(2)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的化学方程式为[用Fe和HNO3(稀)反应表示]______________________________________。
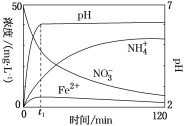
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
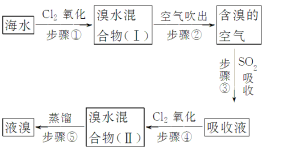
(1)步骤①反应的离子方程式是_____________________________。
(2)步骤③反应的化学方程式是______________________________。
(3)从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(4)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的离子半径由大到小的顺序为__________________。(用离子符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________ 。(用化学式)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)由表中①④两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ _。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中①②两种元素可以组成多种烃,若原子也按1:1组成的常见液态化合物是重要的化工原料,也是常见的有机溶剂,写出该物质与硝酸发生反应的化学方程式: _______________。
(6)⑥的单质在⑤的最高价氧化物对应水化物中反应的离子方程式为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如图所示的关系:
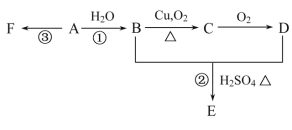
(1)A的分子式为_____,用途为____________________。
(2)写出反应①的化学方程式_____________________,该反应的类型是______。
写出反应②的化学方程式___________________,该反应的类型是_________。
写出反应③的化学方程式____________________________。
(3)写出B生成C的方程式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com