
科目: 来源: 题型:
【题目】下面关于硅及其化合物的叙述中,不正确的是 ( )
A.可用氢氟酸在玻璃上雕刻花纹
B.晶体硅可用作半导体材料
C.硅胶可用作食品干燥剂
D.硅元素化学性质不活泼,在自然界中可以游离态形式存在
查看答案和解析>>
科目: 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-

下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种短周期元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C﹣离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍.请填写下列空格:
(1)推断A、B、C、D四种元素的符号A_____;B_____;C_____;D_____;
(2)C的一价阴离子的结构示意图_____;
(3)D元素的最高价氧化物的结构式是_____;
(4)C、D两元素形成的化合物电子式_____,分子内含有_____键 (填极性或非极性).
(5)用电子式表示A、C两元素形成的化合物的过程_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质的分类、名称(或俗名)、化学式中不能完全对应的是 ( )
A.酸性氧化物、三氧化硫、SO3B.碱性氧化物、过氧化钠、Na2O2
C.正盐、苏打、Na2CO3D.含氧酸、次氯酸、HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室常用的几种气体发生装置如图A、B、C所示:
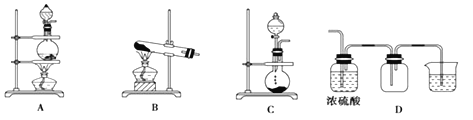
回答下列问题:
①若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的_____。
A.CO2 B.H2 C.Cl2 D.NH3
②D装置的小烧杯中应盛放NaOH溶液,目的是__________________。
③若要收集干净纯净的X气体,上述装置应如何改进____________________。
④若用B装置制取氨气可以用_________(填试剂名称)进行干燥。
(2)某化学兴趣小组为探究SO2的性质,按下图所示装置进行试验。

请回答下列问题:
①装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_________、________。
②反应后,装置B中发生的现象是____________,装置D表现了SO2的_____性,装置E表现了SO2的______性。
③F装置漏斗的作用是_____________。
④装置C中发生的离子方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,写出此反应的离子方程式:_______。
,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O![]() 转化为______(填微粒的化学式)
转化为______(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.用酒精灯加热Fe(OH)3生成FeOB.实验室加热NH4Cl固体制取NH3
C.SO2和过量氨水反应生成(NH4)2SO3D.Na在空气中燃烧制取Na2O
查看答案和解析>>
科目: 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_______。
(2)高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
① Na2FeO4中铁元素的化合价是______价。
② 用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是_______(用离子方程式表示)。
③ 工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 +10NaOH+3NaClO=2_____+5_____+9_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com