
科目: 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,停止滴定。
e.重复上述操作两次。三次测定数据如表:

f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________。
(2)滴定应在pH<0.5的条件下进行,其原因是_____________________。
(3)b和c两步操作是否可以颠倒________,说明理由___________________________。
(4)滴定终点的现象为______________________________。测得c(I-)=________ mol·L-1。
(5)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图甲、乙、丙为组成生物体的相关化合物,乙为一个由α、β、γ三条多肽链形成的蛋白质分子,共含271个氨基酸,图中每条虚线表示由两个硫基(-SH)脱氢形成一个二硫键(-S-S-)。下列相关叙述不正确的是

A. 甲为组成乙的基本单位,且乙中最多含有20种甲
B. 由不同的甲形成乙后,相对分子质量比原来少了4 832
C. 丙主要存在于细胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R为C3H5O2,则由两分子甲形成的化合物中含有16个H
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中 A.B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请回答问题:
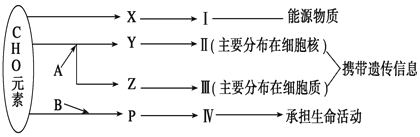
(1)图中X被形容为“生命的燃料”,它是____________,Ⅰ在小麦种子中主要是指____________。
(2)A和B各表示__________ 元素 和______________元素。
(3)Y完全水解的产物是__________、 _____________ 和 ________________。
(4)P的结构通式是____________________,P的种类有_____________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
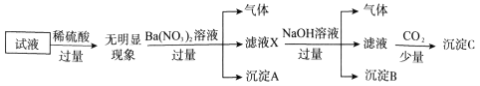
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为___________________________________。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中Ag+的浓度为________mol·L-1,pH为________。
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=________mol·L-1。

(4)25℃,0.10mol·L-1CH3COONH4溶液中粒子浓度由大到小的顺序为____________________(已知醋酸和一水合氨的电离常数相等)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应Fe3++ Ag ![]() Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是_____________________________(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是_______(填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c .铁元素质量减小
(3)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:

①过程Ⅰ中反应的离子方程式是_______________________、_____________________。
②过程Ⅱ中加入的试剂可以是_______________。
(4)镀银后的银氨溶液(Ag(NH3)2OH)放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是_____________________。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为_______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应其△H=-122 kJ/mol,S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行
C.仅在高温下自发进行D.仅在低温下自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com