
科目: 来源: 题型:
【题目】下列关于决定物质体积的因素的说法中不正确的是( )
A.物质的体积取决于粒子数目、粒子大小和粒子间距
B.相同条件下,粒子数相同的任何气体都具有相同体积
C.同温同压下,1 mol任何物质所占的体积都相同
D.等质量的氢气,压强越小、温度越高,其体积越大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.极性分子一定不含非极性共价键
B.CO2、PH3、CH4均为非极性分子
C.NF3中N—F键的键角小于NH3中N—H键键角
D.二氯甲烷(CH2Cl2)分子中键角均为109o28’
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
B. 淀粉、纤维素和油脂都属于天然高分子化合物
C. 油脂、淀粉、蔗糖和葡萄糖在一定条件下都能发生水解反应
D. 肌醇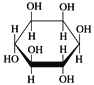 与葡萄糖
与葡萄糖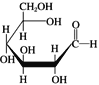 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此均属于糖类化合物
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此均属于糖类化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以A为主要原料来合成乙酸乙酯,其合成路线如下图所示。其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。又知2CH3CHO+O2![]() 2CH3COOH。请回答下列问题:
2CH3COOH。请回答下列问题:
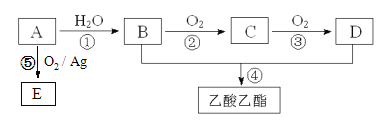
(1)写出A的电子式________________________。
(2)B、D分子内含有的官能团分别是________、________(填名称)。
(3)写出下列反应的反应类型:①______________,④______________。
(4)写出②反应的化学方程式: _______________________;
(5)E是C的同分异构体,其结构简式为___________;传统生产E的方法是氯代乙醇法,先生产2-氯乙醇,再与Ca(OH)2反应制得。与传统方法相比采用反应⑤的优势在于_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。

步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二:打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C试管中溶液的pH。
结合上述实验,回答以下问题:
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_______________________。
(2)甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质_____________,该物质发生电离所致。
(3)通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是_______________________。
测定结果如下:
第1次实验 | 第2次实验 | 第3次实验 | |
B瓶中pH | 2.15 | 2.10 | 2.17 |
C瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现:C瓶中溶液的酸性始终比B瓶中的酸性强。
(4)通过查阅文献,I﹣可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程分两步进行如下,将ii补充完整。
i.SO2+4I﹣+4H+=S↓+2I2+2H2O
ii.I2+2H2O+___═___+___+2I﹣
(5)最终结论:C瓶中溶液酸性强于B瓶,是由于生成了____________,该过程中体现出二氧化硫哪些化学性质________________(选填“氧化性”,“还原性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___molL﹣1s﹣1。
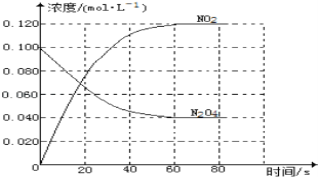
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
查看答案和解析>>
科目: 来源: 题型:
【题目】有人设计了一套实验分馏原油的五个步骤:
①将仪器a固定在铁架台上,在仪器a上塞好带温度计的橡皮塞。
②连接好冷凝管。把冷凝管固定在铁架台上,将冷凝管进水口的橡皮管的一端和水龙头连结,将和出水口相接的橡皮管的另一端放在水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度确定铁圈的高度,放好石棉网。
④向仪器a中放入几片碎瓷片,再用漏斗向仪器a中加入原油,塞好带温度计的橡皮塞,把连接器连接在冷凝器的末端,并伸入接收装置(如锥形瓶)中。
⑤检查气密性(利用给固定装置微热的方法)。请完成以下题目:

(1)上述实验正确的操作顺序是:_______(填序号)。
(2)仪器a的名称为:______。
(3)冷凝管里水流的方向为____进____出。(填f或g,注:上为f下为g)。
(4)分馏原油是利用了原油中各组分的______不同而达到分离的目的。
(5)仪器a中放几片碎瓷片的目的是______。
查看答案和解析>>
科目: 来源: 题型:
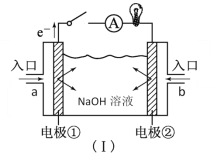
【题目】(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____,写出电极②发生反应的电极反应式______。
(2)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变)。
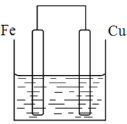
①铁片上的电极反应式为_____。
②溶液中的铜离子移向____(填铁电极或铜电极)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为检验某溴代烃(R-Br)中的溴元素,有下列实验操作:
①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却;正确操作的先后顺序是( )
A.③⑤①⑥④②B.③⑤①⑥②④C.③①⑤⑥②④D.③①②⑥④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com