
科目: 来源: 题型:
【题目】下列反应既不属于氧化还原反应,又是吸热反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)28H2O与NH4Cl的反应
C. 生石灰与水反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖、果糖和蔗糖都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
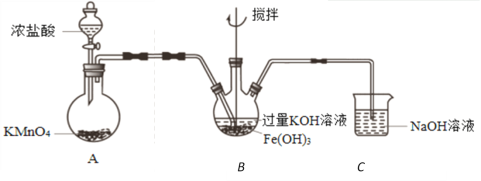
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应 A(s)+3B(g)=2C(g)+2D(g),在不同条件下测得反应速率,其中最快的是
A. υ(C)=0.3 mol/(L·s)B. υ(D)=0.35 mo/l(L·s)
C. υ(B)=0.6 mol/(L·s)D. υ(A)=0.3 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】化石燃料燃烧时会产生 SO2进入大气,有多种方法可用于 SO2的脱除。
(1)NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2。
①反应离子方程式是__________________________________________。
②为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
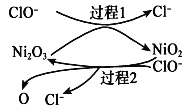
a.过程1的离子方程式是Ni2O3+ClO- =2NiO2 +Cl-,则过程2的离子方程式____________。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是________________。
(2)碘循环工艺也能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
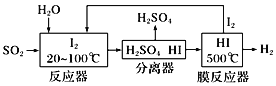
则碘循环工艺的总反应为:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气的主要成分为CH4,可将CH4设计成燃料电池,来解决能源问题,装置如图所示。在标准状况下,持续通入甲烷,消耗甲烷VL。下列说法错误的是

A. 当0<V≤33.6 L时,负极反应式为CH4+10OH--8e-== CO32-+7H2O
B. 正极反应式为O2 +4H+ +4e-==2H2O
C. 当V=67.2 L时,电池总反应方程式可写为CH4+2O2+NaOH== NaHCO3+2H2O
D. 电解质溶液中的Na+向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置为________________。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________;所含化学键类型_________。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________。
Ⅱ.如下图转化关系:![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
![]()
A. 若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应
B. 简单阴离子半径:M>Z>Y
C. 最高价氧化物对应水化物的酸性:Z>M
D. 若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com