
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
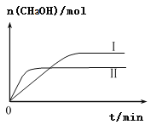
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
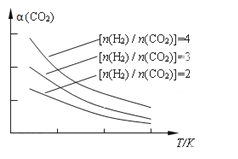
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
(1)增加Fe的物质的量,其正反应速率___________。(A.变快 B.不变 C变慢,前4问填字母代号)。
(2)将容器的体积缩小一半,其正反应速率___________ ,逆反应速率___________。
(3)若保持体积不变,充入Ar,其逆反应速率___________
(4)保持压强不变,充入Ar,其正反应速率 ___________。
(5)保持压强不变,充入Ar,该反应向___________ 方向移动。(填正移、逆移或不移)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素。已知:A、B、C、E在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小; A与B质子数之和是D质子数的3倍;C m- 、E (m-1)- 具有相同的电子层结构;热稳定性:H m D>H m C。依据上述信息用相应的化学用语回答下列问题:
(1)H m D m 的电子式为____________________
(2)C m- 、E (m-1)- 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)B单质与A的最高价氧化物对应水化物反应的化学方程式为:______________________。
(4)常温下,将CD m 通入H m C溶液中,有C析出,写出该过程的化学方程式__________________ 。
(5)在A、B、C、E单质中,符合下列转化关系的是___________(填元素符号)。![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
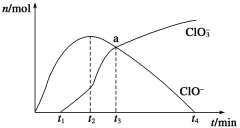
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
A. 生成C的速率是生成A的速率的两倍
B. A、B、C的浓度相等
C. 单位时间生成 n mol A,同时生成 3n mol B
D. A、B、C的分子数之比为 1∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列有机物中符合要求的官能团的名称。
(1)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如下所示:
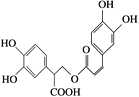
该物质中含有的官能团有________________。
(2)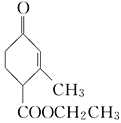 中含有的官能团是____________。
中含有的官能团是____________。
(3)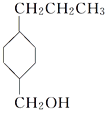 中含有的官能团是____________。
中含有的官能团是____________。
(4)![]() 中显酸性的官能团是________________,另一官能团是________________。
中显酸性的官能团是________________,另一官能团是________________。
(5) 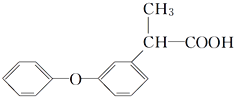 中含氧官能团是________________。
中含氧官能团是________________。
(6)![]() 中不含氧原子的官能团是________________。
中不含氧原子的官能团是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com