
科目: 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如下:
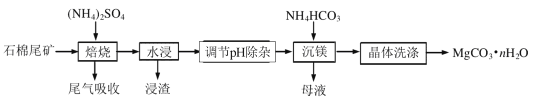
已知“焙烧”过程中的主反应为:
![]()
(1)写出焙烧产物NH3的电子式_____________________。
(2)为提高水浸速率,可采取的措施为_______________________(任写一条),“浸渣”的主要成分为__________________。
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是______________,此时溶液中的c(Fe3+)=__________________(已知Ksp[Fe(OH)3]=4.0×10-38)。
(4) “沉镁”过程中反应的离子方程式为_______________________________________。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是________________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目: 来源: 题型:
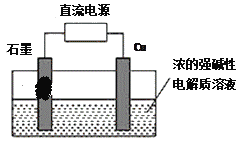
【题目】I、依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设
计的原电池如图所示。请回答下列问题:

(1)电极X的材料是___________;(填化学式)电解质溶液Y是___________;X电极上发生的电极反应为________________________________;
(2)用两个铂丝做电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,请写出负极的电极反应式____________________________在电池工作时,正极附近溶液的PH_________,(填,增大、减小或不变)
II、用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。铜电极为_________(填“阳极”和“阴极”)写出铜电极的电极反应式_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________ ,已知光照条件下D与F反应生成B,写出该反应的化学方程式:______________________________________
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是

A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
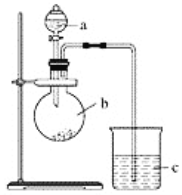
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为原电池装置示意图。
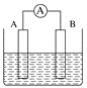
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(l) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示:
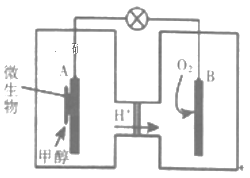
A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。
(4)一定条件下,在体积为5 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
①在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____
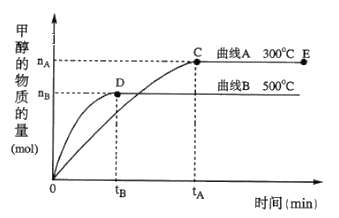
A.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com