
科目: 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两个装置,下列说法错误的是( )
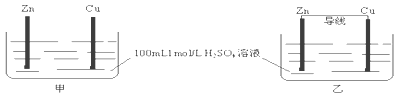
A. 甲、乙装置中,Zn的质量均减小B. 甲、乙装置中,Cu上均有气泡产生
C. 化学反应速率乙>甲D. 甲中H+移向Zn,乙中H+移向Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
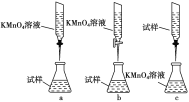
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
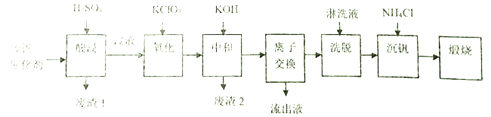
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
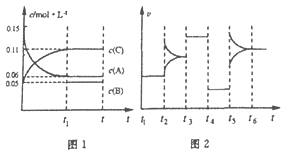
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A. 测定密度 B. 放入硝酸中 C. 放入盐酸中 D. 观察外观
查看答案和解析>>
科目: 来源: 题型:
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表,下列说法中正确的是( )
溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 8.3 | 5.2 |
A. 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-===HClO+HSO
B. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO)>c(SO![]() )>c(OH-)
)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com