
科目: 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
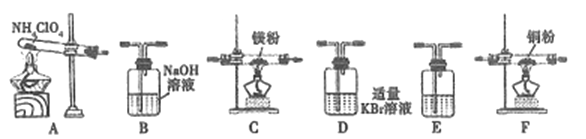
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
(1) | 升高温度 | _________ |
(2) | 加入催化剂 | ________ |
(3) | 再充入a mol H2 | ________ |
(4) | 将容器容积扩大为原来2倍 | ________ |
(5) | 通入b mol Ne(g) | ________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+![]() O2(g)===H2O(g);ΔH=-Q1 kJ·mol-1
O2(g)===H2O(g);ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(l);ΔH=-Q2 kJ·mol-1
则下列判断正确的是 ( )
A. 2Q1>O2 B. Q1>2Q2 C. 2Q1<Q2 D. ![]() Q2=Q1
Q2=Q1
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物I是治疗制揽伤的药物,合成I的--种路线如下:
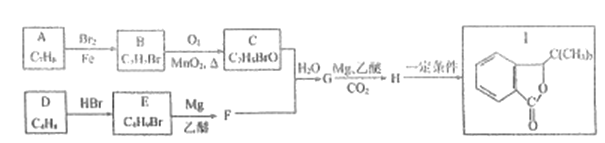
已知:
①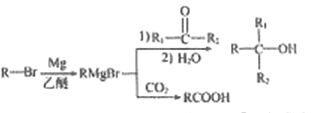
②E的核磁共振氢谱只有1组峰
③C能发生银镜反应。
请回答下列问题:
(1)有机物C的结构简式________,D的化学名称________。
(2)C中所含官能团的名称为__________.
(3)H![]() I的化学方程式为_______,其反应类型为_____。
I的化学方程式为_______,其反应类型为_____。
(4)X与B含有相同的官能团,相对分子质量比B大14,X的结构有______种,其中核磁共振氢谱有4组峰,且峰面积之比为2:2:3:3的有________ (写结构简式)。
(5)写出用乙烯为原料制备化合物 (丁二酸二乙酯)的合成路线_______ (其他无机试剂任选)。
(丁二酸二乙酯)的合成路线_______ (其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+![]() O2(g)===H2O(g);ΔH=-241.8 kJ/mol
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+![]() O2(g)===H2O(l);ΔH=-285.8 kJ/mol
O2(g)===H2O(l);ΔH=-285.8 kJ/mol
则氢气的燃烧热为
A. 438.6 kJ/mol B. 241.8 kJ/mol C. 285.8 kJ/mol D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物品或设备:①水泥路桥、②门窗玻璃、③水晶镜片、④石英钟表、⑤玛瑙手镯、⑥硅太阳能电池、⑦光导纤维、⑧计算机芯片所用材料为SiO2或要用到SiO2的是 ( )
A.①②③④⑤⑦B.全部C.⑥⑧D.①②⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】已知石墨和金刚石燃烧化学方程式如下:
C(石墨,s)+O2(g)==CO2(g)
C(金刚石,s)+O2(g)==CO2(g)
质量分别为12 g的石墨和金刚石在某一相同条件下燃烧时放出的热量分别为393.8 kJ和395.2 kJ,问:对于单质来说,稳定的单质是石墨还是金刚石?简述理由。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)基态铁原子的价电子排布图为_______
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_____Fe3+(填“大于”或“小于”),原因是____。
(3)纳米氧化铁能催化火管推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),其中氮原子的杂化方式为______;与 ClO4-互为等电子体的分子或离子为_________(任写两种)。
(4)金属铁晶体原子采用体心立方堆积。则铁晶体的空间利用率为____ (用含π的式子表示)。
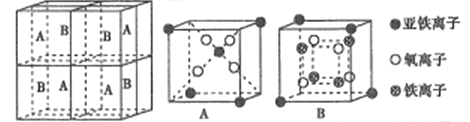
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。
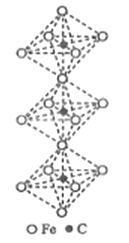
(6)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低CO、NOx及碳氧化合物的排放。回答下列问题:
(1)引发光化学污染的气体是__________
(2)以NO为例,已知:
①H2(g)+1/2O2(g)=H2O(g) ΔH1
②2NO(g)+O2(g)=2NO2(g) ΔH2
③N2(g)+2O2(g)=2NO2(g) ΔH3
④2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4=-664.14 kJ/mol
⑤2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH5=-746.48 kJ/mol
①②③④反应热效应之间的关系式为ΔH4=_______;有利于提高NO转化率的反应条件是_____;
在尾气处理过程中防止NO与H2反应生成NH3,提高其反应选择性的关键因素是________.
(3)研究表明不同负载钯量催化剂对汽车尾气处理结果如图所示,

根据图1和图2可知催化剂最佳负载钯的量为______;当负载钯的量过大时,三种尾气的转化率反面下降的原因是___________。
(4)向2L密闭容器中加入2molCO、4molH2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1molCO生成的同时有1molO-H键生成
(5)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为__________
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com