
科目: 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料。具体合成路线如图所示 ( 部分反应条件略去 ):
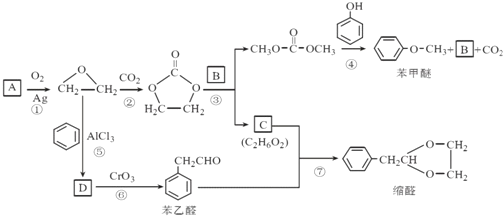
已知:①![]()
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%.
回答下列问题:
(1)A的名称是 ___ ,图中缩醛的分子式是 ___.
(2)B的结构简式为 ___.
(3)⑤的化学方程式为 ___.
(4)⑥的反应类型是 ___.
(5)请写出核磁共振氢谱有 4 组峰 , 峰面积之比为 3:2:2:1, 并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式: ___.
结构的苯乙醛的所有同分异构体的结构简式: ___.
(6)参照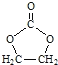 的合成路线,设计一条由2氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2氯丙烷和必要的无机试剂制备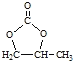 的合成路线(注明必要的反应条件 )___。
的合成路线(注明必要的反应条件 )___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.
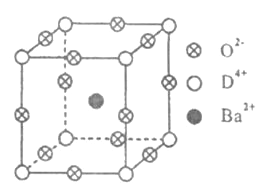
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________(填元素符号).
(2)BA4分子的空间构型是______________;B原子轨道的杂化类型为_____.
(3)C的气态氢化物的电子式为____;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________.
(4)D的基态原子核外电子排布式为____________________.
(5)①制备化合物甲的化学方程式为____________________.
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________.
③在甲晶体中,D4+的氧配位数为__________.
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________g/cm3(要求列出算式,阿伏加德罗常数用NA表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠 杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓 CuSO4 溶液,一段时间后,下列 有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)
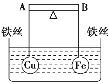
A. 杠杆为导体和绝缘体时,均为 A 端高 B 端低
B. 杠杆为导体和绝缘体时,均为 A 端低 B 端高
C. 当杠杆为绝缘体时,A 端低 B 端高;为导体时,A 端高 B 端低
D. 当杠杆为绝缘体时,A 端高 B 端低;为导体时,A 端低 B 端高
查看答案和解析>>
科目: 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是( )
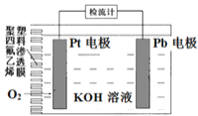
A. Pt电极上发生还原反应
B. 随着使用,电解液的碱性逐渐减弱
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室需要配制0.1 mol·L-1NaOH溶液500mL。
(1)根据计算用托盘天平称取的质量为__________g。在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
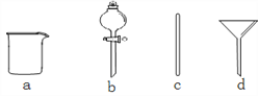
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)下面操作造成所配NaOH溶液浓度偏高的是_____。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
II.向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再向所得溶液中滴加0.1 mol/L盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
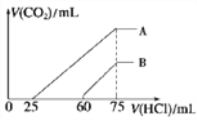
(4)①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有某烷烃与烯烃的混合气体9.00g,该混合气体的密度为相同状况下氢气的11.25倍,将混合气体通过足量溴水,溴水质量增加4.20g,则原混合气体的组成为( )
A. 甲烷 、乙烯B. 乙烷 、乙烯C. 甲烷 、丙烯D. 甲烷 、丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )
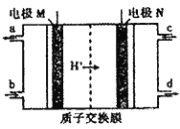
A. M极生成氮气且电极附近溶液酸性增强
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目: 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。C是A与水在一定条件下加成的产物,可以被酸性高锰酸钾溶液直接氧化成D,C和D在一定条件下可得到具有水果香味的物质E。回答下列问题:
(1)A的电子式 ________;
(2)在碘水中加入B振荡静置后的现象____________;
(3)写出C和D反应生成E的化学方程式____________;
(4)为了更好的闻到E物质的水果香味,实验中要用到饱和碳酸钠溶液,分离E和饱和碳酸钠溶液的方法是_____。写出少量D与饱和碳酸钠溶液反应的离子方程式_______;
(5)等质量的A、B完全燃烧时消耗O2的物质的量___(填“A>B”或“A<B”或“A=B”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com