
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
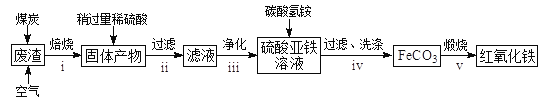
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
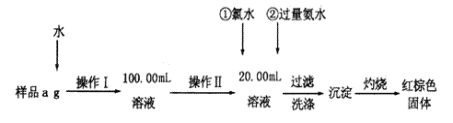
(1)操作I所用到的玻璃仪器除烧杯、量筒、100mL的容量瓶外,还必须有_________(填仪器名称)。容量瓶使用前必须进行的操作是_________(填序号)
A.干燥 B.验漏 C.润湿
(2)写出加入氯水发生反应的离子方程式_______________________________________。该反应若不用氯水,可用下列试剂中的______________代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(3)检验沉淀已经洗涤干净的操作及现象是__________________________。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________(列出原始算式,不需化简)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Na、Mg、Al分别与足量的盐酸反应,放出的氢气在相同条件下体积比为1:2:3,则Na、Mg、Al三种金属的物质的量之比为( )
A.1:1:1B.1:2:3C.1:1:2D.3:3:4
查看答案和解析>>
科目: 来源: 题型:
【题目】I、将0.1 gMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
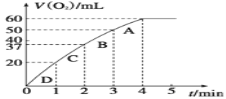
解释反应速率变化的原因:____________________________;计算H2O2的初始物质的量浓度为_________。(保留两位有效数字)
Ⅱ、苯和甲烷是两类烃的代表物质,回答下列问题:
(1) 常温常压下,气态直链烷烃含碳原子数≤_________ 。
(2) 苯和甲烷中含碳量较高的是__________。
(3) 若将等物质的量的苯和甲烷分别燃烧,耗氧量较大的是________________。
(4)写出苯与溴单质反应的化学方程式 __________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中分子数相同的是
A. 2 L一氧化碳和2 L 二氧化碳
B. 9 g水和标准状况下11.2 L二氧化碳
C. 标准状况下1 mol氧气和22.4 L水
D. 0.2 mol 氢气和4.48 L氯化氢气体
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )
实验 | 实验现象 | 结论 | |
A |
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B |
| 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C |
| 左边烧杯中无明显变化,右边烧杯中澄清石灰水变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
D |
| 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为____________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A. NaCl的摩尔质量是58.5g
B. 在1L水中溶解5.85gNaCl,即可配制得0.1mol/L的NaCl溶液
C. 标准状况下,22.4L H2O含有氢原子的数目为2NA
D. 17g NH3中含有分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com