
科目: 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示:关于乙醇在各种不同反应中断键的说法不正确的是 ( )
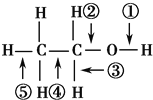
A. 和金属钠反应键①断裂
B. 在Ag催化下和O2反应键①④断裂
C. 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂
D. 和氢溴酸反应键①断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个容积为2L的密闭容器内进行如下反应:A2(g)+3B2(g)=aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。
请计算:
(1)a值_______。
(2)X的表示式(用A、B表示)_______。
(3)2min末A2的浓度________。
(4)B2的化学反应速率为_______。
(5)2min末B2的转化率为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
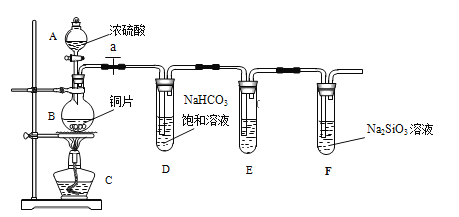
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质不属于同分异构体的是 ( )
A. 2,2-二甲基丙醇和2-甲基-1-丁醇 B. 甲基丙烯酸和甲酸丙酯
C. 2-甲基丁烷和戊烷 D. 邻氯甲苯和对氯甲苯
查看答案和解析>>
科目: 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为____反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是____(填字母)。
A.改铁片为铁粉 B.滴加少量CuSO4 溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______极(填“正”或“负”)。铜片上产生的现象为________,该极上发生的电极反应为_______。2min后铁片的质量减少1.4 g,则导线中流过的电子为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
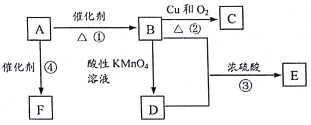
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
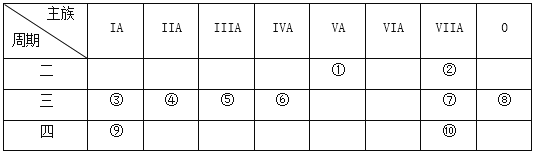
(1)在③~⑦中元素,原子半径最大的是_____________,其离子的结构示意图是__________________。
(2)表中的①~⑩中元素,非金属性最强的是_______,化学性质最稳定的是________,金属性最强的是__________,最高价氧化物的水化物的酸性最强的是(写该水化物的化学式)______________。
(3)⑦的氢化物的水溶液与①的氢化物的水溶液反应的离子方程式为___________________________。
(4)用一个化学反应说明⑦比⑩的单质化学性质活泼,写出反应的化学方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于ΔH的说法正确的是 ( )
A.在任何条件下,化学反应的焓变都等于化学反应的反应热
B.ΔH>0时反应放热,ΔH<0时反应吸热
C.ΔH越大,说明反应放出的热量越多
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______0(填“>”或“<”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度 c.增大B的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com