
科目: 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有
A. Fe Mn Zn Mg B. Zn Cu Mg Ca
C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
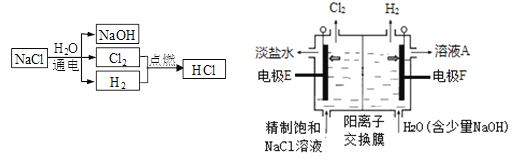
(1)生成H2的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液A的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
ⅰ. 实验①中所得混合溶液,由水电离出的c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的![]() :①___________③(填“>”“<”或“=”)。
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中的Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。

下列表述正确的是_______。
A. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时效果差
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目: 来源: 题型:
【题目】若以鸡蛋蛋白液为材料进行蛋白质鉴定实验,发现蛋白液与双缩脲试剂发生反应后会粘固在试管壁上。下列关于这一现象形成原因的描述中正确的是( )
A. 鸡蛋蛋白液稀释不够,搅拌不匀
B. 只添加了双缩脲试剂A,未添加双缩脲试剂B
C. 鸡蛋蛋白液不是合适的实验材料
D. 蛋白液与双缩脲试剂的反应时间不够长
查看答案和解析>>
科目: 来源: 题型:
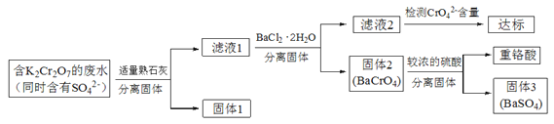
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
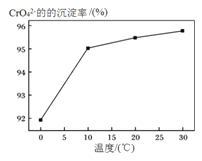
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
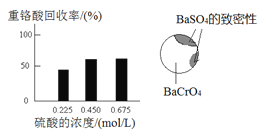
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
查看答案和解析>>
科目: 来源: 题型:
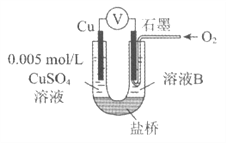
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1
它由两步反应组成:i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177 kJ·mol-1 ii. SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

① X代表的物理量是_____________________。
② 判断L1、L2的大小关系是______________。
(2)反应Ⅱ:I-可以作为催化剂,可能的催化过程如下。
i. SO2+4I-+4H+=S↓+2I2+2H2O; ii. I2+2H2O+ SO2= SO42-+4H++2I-;
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol/L KI | a mol/LKI 0.2 mol/LH2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=__________。
② 比较A、B、C,可得出的结论是_______________________________。
③ 实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________。
(3)在钠碱循环法中,Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

① 上表判断NaHSO3溶液显__________性,用化学平衡原理解释:_____________。
② HSO3-在阳极放电的电极反应式是______,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com