
科目: 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)减小
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
科目: 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.5 molL -1 盐酸与50 mL0.55 mol L -1 NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。

(2)烧杯间填满碎纸条的作用是______________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值_______(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 molL -1 盐酸跟50 mL 0.55 molL -1 NaOH溶液进行反应,与上述实验相比,所放出的热量 _______(填“相等”或“不相等”),所求中和热 _____(填“相等”或“不相等”),简述理由_______________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 molL -1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会__________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 图①表示不同压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
B. 图②表示向10ml0.1mol·L-1Na2CO3和NaHCO3两种溶液中分别滴加0.lnol·L-1HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液
C. 图③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液
D. 图④表示该反应为放热反应,且催化剂能改变反应的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示:
物质 | 熔点/ ℃ | 沸点/ ℃ | 密度/ g·cm3 | 水中的溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙互相分离的方法是
A. 蒸馏法 B. 升华法 C. 萃取法 D. 过滤法
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
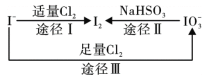
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】依据不同的分类标准,HNO3可属于下列中的哪一类
①氧化物 ②含氧酸 ③一元酸 ④混合物 ⑤电解质
A. ②③⑤ B. ①②③ C. ①②④ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 无水FeCl3
无水FeCl3
B. Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() AlCl3(aq)
AlCl3(aq)
C. NH3![]() NO
NO![]() HNO3
HNO3
D. SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com