
科目: 来源: 题型:
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:
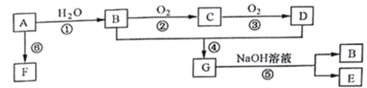
(1)写出A的电子式____________,B、D分子中的官能团名称分别是 _______、_______。
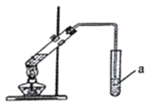
(2)在实验室中,可用如图所示装置制取少量G,试管a中盛放的试剂是____________,其作用为____________;
(3)写出下列反应的化学方程式,并注明反应类型:
①_______________________________ ;
②________________________________;
④________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
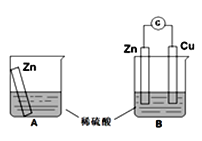
(1)B中Zn板是_________极,发生的电极反应是_________________,Cu板上的现象是___________;
(2)从能量转化的角度来看, A中是将化学能转变为_________,B中主要是将化学能转变为_________;
(3)该小组同学反思原电池的原理,其中观点正确的是_________;
A.原电池反应的过程中一定有电子转移
B.电极一定不能参加反应
C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极
D.氧化反应和还原反应可以拆开在两极发生
(4)在B中,当导线中有1mol电子通过时,理论上的两极变化是_________。
A.锌片溶解32.5g B.锌片增重32.5g
C.铜片上析出2gH2 D.铜片上析出1mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
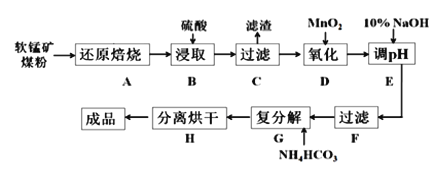
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_________________。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
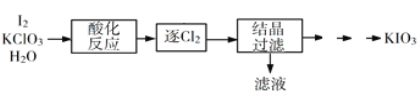
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是______________________。
“滤液”中的溶质主要是__________________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
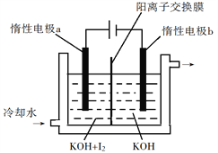
①写出电解时阴极的电极反应式________________________________。
②电解过程中通过阳离子交换膜的离子主要为_______________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有___________________________________________(写出一点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各组物质:①O2和O3;②![]()
![]()
![]() ;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和
;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和![]() ;⑥2-甲基丁烷、异戊烷。
;⑥2-甲基丁烷、异戊烷。
其中互为同位素的是_______;互为同素异形体的是_______;互为同系物的是_______;互为同分异构体的是_______;属于同种物质的是_______。(用序号填空,下同)
(2)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

①该反应为______反应(填“放热”或“吸热”)。
②A和B的总能量比C和D的总能量___(填“高”或“低”)。
③物质中的化学能通过______转化成______释放出来。
④反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
⑤写出一个符合题中条件的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在容积固定的密闭容器中充入CH4、CO2 发生此反应![]() ,下列选项可说明上述反应达到平衡状态的是( )。
,下列选项可说明上述反应达到平衡状态的是( )。
A. 混合气体的密度不再发生变化B. 混合气体的平均相对分子质量不再发生变化
C. 混合气体的总质量不再发生变化D. 相同时间内每断开2mol C=O键,同时断开1mol H-H键
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
①Y的原子结构示意图是______________,甲的空间构型为__________。
②写出向硝酸铝溶液中通入过量气体甲的反应的离子方程式_________________。
(2)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
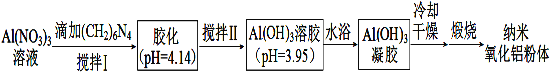
已知:①(CH2)6N4水溶液显碱性。
②Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在。
凝胶中含有的硝酸盐除硝酸铝外还有___________________(填物质名称)。
(3)“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。某含铝“拟晶” 的化学式为:Al65Cu23Fe12, 它是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。下列有关这种拟晶的说法正确的是_______________。(填标号)
A.无法确定Al65Cu23Fe12中三种金属的化合价
B.Al65Cu23Fe12的硬度小于金属铁
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型最能体现“原子经济性”原则的是
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A.①②B.③④C.②⑤D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com