
科目: 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组的同学查阅相关资料知,氧化性:Cr2O72->Fe3+,设计了如图所示的盐桥原电池。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是
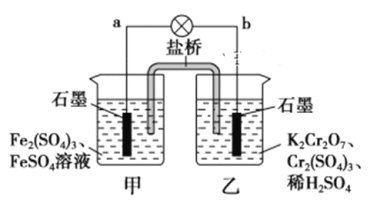
A. 甲烧杯的溶液中发生还原反应
B. 外电路的电流方向是从b到a
C. 电池工作时,盐桥中的SO42-移向乙烧杯
D. 乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-===Cr2O72-+14H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目: 来源: 题型:
【题目】装置(1)为铁镍(Fe-Ni)可充电电池:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
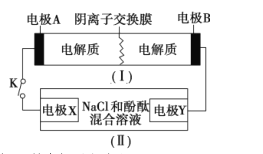
A. 闭合开关K时,电极X的电极反应式为2H++2e-===H2↑
B. 闭合开关K时,电极A的电极反应式为Ni2O3+2e-+2H++H2O===2Ni(OH)2
C. 给装置(I)充电时,电极B上参与反应的物质被氧化
D. 给装置(I)充电时,OH通过阴离子交换膜移向电极A
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中,从海带里提取碘的部分流程如下图,下列说法不正确的是

A. 步骤①灼烧海带需要用坩埚
B. 步骤③主要操作为过滤
C. 步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2
D. 步骤⑤可以加入酒精萃取I2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸铅[(CH3COO)2Pb]因有甜味而被称为“铅糖”,它有毒但能入药。已知(CH3COO)2Pb可溶于水,硝酸铅与醋酸钠溶液反应的离子方程式为Pb2++2CH3COO-![]() (CH3COO)2Pb。下列有关说法中不正确的是
(CH3COO)2Pb。下列有关说法中不正确的是
A. 0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1
B. “铅糖”是强电解质
C. “铅糖”是共价化合物
D. “铅糖”的溶液可能导电性很弱
查看答案和解析>>
科目: 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
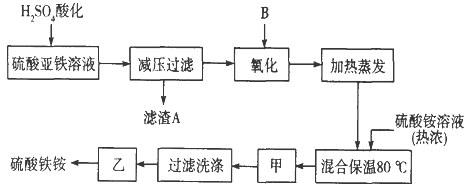
请回答下列问题:
(1)滤渣A的主要成分是__________________。
(2)下列物质中最适合的氧化剂B是________;反应的离子方程式__________________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________,乙___________________。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量溶液检验Fe2+是否已全部被氧化,所加试剂能否用酸性的KMnO4溶液?____(填“能”或“不能”)理由是: ________________________。(可用语言或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是________________________________________。
(6)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3) 2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是( )
A. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
B. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡: NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com