
科目: 来源: 题型:
【题目】已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。

(1)试判断:A的化学式为_____________,B的名称为_______________。
(2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_________色,则含该离子。
(3)实验室检验D溶液中的阳离子时,通常可滴加_________,若溶液变为_______色,则含该离子。
(4)若E是一种黄绿色气体单质,该气体是________________,在C→D过程中,此气体做_________剂。
(5)写出固体B与过量盐酸反应的离子方程式__________________________。
(6)写出D + A→C的离子方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是

A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N____________C (填“>”“<”或“=”),请设计实验证明:____________________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(实验一)实验室通过如下图所示装置制备Na2S2O3。
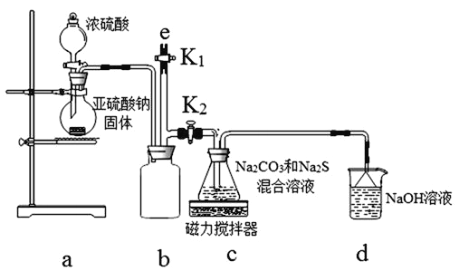
(3)b装置的作用是________________________。c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__________________________________________________________。
(4)实验结束后,在e处最好连接盛____________(填“NaOH溶液”、“水”、“CCl4”中一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且 CN-优先与 Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指 示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定终点的现象:________________________________________________。
(6)处理后的废水是否达到排放标准:____________________________________ (填“是”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
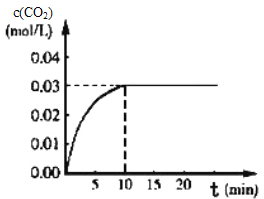
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关元素及其化合物性质的比较正确的是( )
A.原子半径:F<O<AlB.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4D.碱性:LiOH<NaOH<Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
A. SO2、O2分别为0.4 mol/L、0.2 mol/L B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L D. SO2为0.24 mol/L,SO3为0.14 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com