
科目: 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为___________________。
(2)由AW两种元素组成的18电子微粒的电子式为______________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________________________。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________________________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放出氢气,若将1molDA和0.5molE单质混合加入足量的水,充分反应后生成气体的体积是___________(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13·6H2O)的工艺流程如下,下列说法错误的是
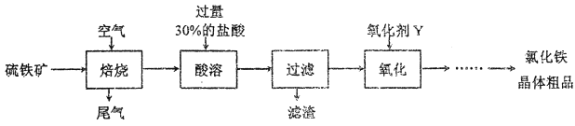
A. 将硫铁矿粉碎再焙烧的目的是加快反应速率
B. 酸溶时需保持盐酸过量的目的是提高铁元素的浸出率
C. 氧化剂Y可以是Cl2不能是H2O2
D. 上述流程中的FeS2可用FeS来代替
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目: 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段的平均反应速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min)
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com