
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
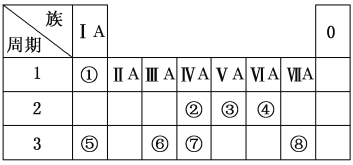
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
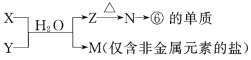
X溶液与Y溶液反应的离子方程式为___________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:2A(g) ![]() B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:

则下列有关说法中正确的是
A. 条件I、条件II时的反应温度不同,压强相同
B. 条件I时可能未使用催化剂,条件II时可能使用了催化剂
C. 条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D. 条件IV和条件II相比较,条件IV时可能缩小了容器体积
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表第四周期的8、9、10列元素为X、Y、Z,它们的化合物在生产生活中有着广泛的应用。回答下列问题(涉及的化学式用元素符号表示)
(1)基态X原子的价电子排布式为______________________,Z2+核外3d能级上有___________对成对电子。
(2)Y3+的一种配离子[Y(N3) (NH3)5]2+中,Y3+的配位数是___________,lmol配离子中所含σ键的数目为___________,配位体N3-中心原子杂化类型为______________________。
(3)Y2+在水溶液中以[Y(H2O)6]2+存在。向含Y2+的溶液中加入过量氨水可生成更稳定的[Y(NH3)6]2+,其原因是____________________________________________。
(4)X离子与KCN形成的蓝色晶体中,X2+、X3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为______________________,立方体中X2+间连接起来形成的空间构型是____________________。
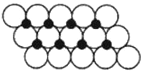
(5)一定温度下,ZO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Z2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为___________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新兴材料——铍日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3 BeO·Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
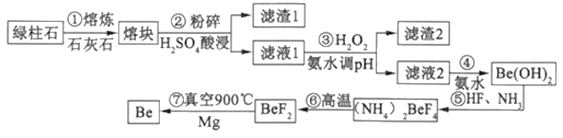
按元素周期表的对角线规则,Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:
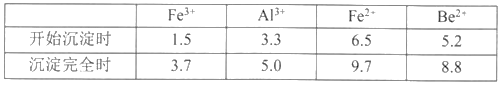
(1)步骤②中将熔块粉碎的目的是___________;滤渣1的主要成分是___________。
(2)步骤③加入H2O2时发生反应的离子方程式为___________,从滤液1中得到沉淀的合理pH为___________(填序号)
A.3.3—3.7 B.3.7—5.0 C.5.0—5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是___________。从溶液中得到(NH4)2BeF4的实验操作是___________、过滤、洗涤、干燥。
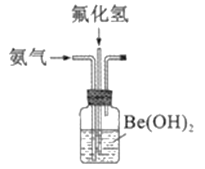
(4)实验室模拟步骤⑤装置如图,控制氨气与氟化氢气体积比的方法是_______________。
(5)步骤⑥的反应类型是___________,步骤⑦需要隔绝空气的环境,其原因是___________。
(6)若绿柱石中BeO的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金___________t。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液能与铝作用生成氢气,则溶液中一定大量共存的离子组是( )
A.Na+、Ba2+、Mg2+、Cl-
B.Cl-、HCO3-、Ca2+、K+
C.NO3-、SO42-、K+、Fe2+
D.Na+、Ba2+、Cl-、Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学学科理论和实践的发展遵循其内在规律,在相近的知识体系间有着密切关联性。
I.分析下列有关电化学装置图
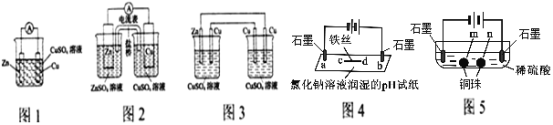
(1)图2装置原电池相比图1装置原电池可获得较长时间的稳定的电流,原因是_________________________________。
(2)将图2装置中CuSO4溶液为电解质溶液,盐桥用铜导线代替后变为图3装置,该装置从左到右电极名称依次是_________________________________。
(3)图4装置中d处电极反应式为:______________________。
(4)根据相同原理,图5装置中两个石墨电极附近有气泡产生,___________处能析出铜。
Ⅱ·温室效应使地球变暧成为人类社会急需解决的重要环境问题。研究表明,在 Cu/ZnO催化剂存在下,H2可还原CO2,发生如下两个平行反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和压强下,经过相同反应时间测得如下实验数据:

注:M--Cu/ZnO纳米棒;N--Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,请回答(不考虑温度对△H的影响):
(1)有利于生成甲醇反应的平衡常数表达式K=______________。
(2)提高CO2转化为CH3OH平衡转化率的措施有___________。
A.使用催化剂M B.使用催化剂N
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com