
科目: 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能源利用的说法中正确的是( )
A.贮氢材料在使用中,氢分子被吸收时,在合金表面解离变成氢原子,同时放出热量
B.使用化石燃料不会带来环境污染问题
C.对城市废弃物进行处理后焚烧,利用产生的热能供暖和发电
D.将氢气作为燃料使用的优点之一是成本低
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s) +CO(g)![]() Fe(s)+CO2(g)(正反应是吸热反应),已知1100℃时K=0.263。
Fe(s)+CO2(g)(正反应是吸热反应),已知1100℃时K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值________;平衡常数K值___________ (选填“增大”“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0.025mol·L﹣1、c(CO)=0.1mol·L﹣1,在这种情况下,该反应是否处于化学平衡状态_________ (选填“是”或“否”),此时,化学反应速率是v(正)_____ v(逆)(选填“大于”“小于”或“等于”),其原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,3.2 g 14C18O中含中子数为1.4NA
B. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象能正确反映对应的变化关系的是( )
A. 向一定量的稀硫酸中滴加氢氧化钠

B. 向一定量的H2SO4和MgSO4混合溶液中滴加氢氧化钡溶液

C. 将足量块状MgCO3和MgO粉末分别加入相同质量、相同质量分数的稀盐酸中
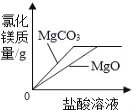
D. 在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌

查看答案和解析>>
科目: 来源: 题型:
【题目】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
SnCl4 | SnBr4 | SnI4 | |
熔点/℃ | -33 | 31 | 144.5 |
沸点/℃ | 114.1 | 202 | 364 |
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________,微粒之间存在的作用力是__________________________________。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________。
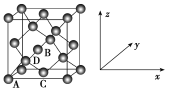
②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)生产过程中X的化学式为________。
(2)写出产生CuCl的化学方程式:__________________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由_____________________________________________________
实际生产中SO2要适当过量,原因可能是_______________________________(答一点即可)。
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为________,当pH较大时CuCl产率变低,原因是________________________________________________________________________。调节pH时,________(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由__________________。
(5)氯化亚铜的定量
①称取样品0.25 g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10 mol·L-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为________(结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com