
科目: 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时发生的反应为:


下列关于该电池叙述错误的是
A. 电池中镀Pt导电玻璃为正极
B. 电池工作时,I-离子在镀Pt导电玻璃电极上放电
C. 电池工作时,电解质中I-和I3-浓度不会减少
D. 电池工作时,是将太阳能转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据物质的量相关计算填空:
(1)在标准状况下,1.6 g 某氧化物RO3体积为0.448L,则R的相对原子量为________。
(2)已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是________。(其中阿伏加德罗常数用NA表示)
(3)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数为________。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/5 mL溶液稀释到VmL,则稀释后溶液中的SO42-的物质的量浓度是______________ 。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好能分别使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法中正确的是
A. 4g甲烷完全燃烧转移的电子数为2NA
B. 11.2L(标准状况)CCl4中含有的共价键数为2NA
C. 3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. 1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为: NH3·BH3+ 3H2O2= NH4BO2+ 4H2O.下列说法正确的是( )

A. 负极附近溶液的PH增大
B. 正极的反应式为:H2O2+ 2H++2e-=2H2O
C. 电池工作时,BO2-通过质子交换膜向正极移动
D. 消耗3.lg氨硼烷,理论上转移0.2mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
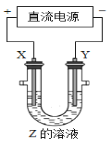
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com