
科目: 来源: 题型:
【题目】NH4Fe(SO4)2·12H2O被称为“铁铵矾”,广泛用于城镇生活用水、工业循环水的净化处理。某同学称取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
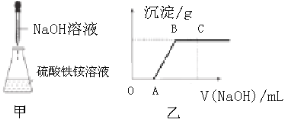
请回答下列问题。
(1)溶解NH4Fe(SO4)2·12H2O固体所用的玻璃仪器有___(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______。
(3)AB段反应的离子方程式为______。
(4)BC段反应的离子方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期律和元素周期表,下列推断不合理的是( )
A. 第84号元素的最高化合价是+7
B. 第七周期0族元素的原子序数为118
C. 第35号元素的单质在常温常压下是液体
D. 位于第四周期第VA族的元素为非金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 克,后加入Na2CO3 克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是 (填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣,以及少量的K+、SO42﹣.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中c(H+)/c(CH3COOH)值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa 固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________________;该混合溶液中:c(A-)-c(Na+)= ________________mol/L(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa
①三种溶液pH由大到小的顺序为:_______________(填序号)
②溶液a的pH大于8,则溶液中c(H2CO3)___ c(CO32―)(填“>” “<”或“=”)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作与安全事故的处理中错误的是( )
A. 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B. 用试管夹从试管底部由下往上夹住距试管口约![]() 处,手持试管夹长柄末端,进行加热
处,手持试管夹长柄末端,进行加热
C. 点燃酒精灯前一定要将酒精添满
D. 把玻璃管插入橡皮塞口时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进孔中
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a___(填“>”“=”或“<”)b。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将__(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度___(填“>”“=”或“<”)w mol·L-1。
(4)能说明该反应已经达到平衡状态的是___。(填序号,下同)
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是___;能使B的转化率增大的操作是________;使平衡向逆反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d..选择高效的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)操作Ⅰ需要用到的玻璃仪器有________,操作Ⅱ的名称是________。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________(填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________。
(5)若先用适量盐酸调节pH值再进行操作Ⅰ,将对实验结果产生影响,其原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com