
科目: 来源: 题型:
【题目】有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 NH4+、Cl-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:① 第一份加入AgNO3溶液有沉淀产生,② 第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲,③ 在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g,④ 第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。根据上述实验回答:
(1)一定不存在的离子是____________________,不能确定是否存在的离子是________________
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):离子符号____________,浓度____________________
(3)试确定K+ 是否存在________ (填“是”或“否”),判断的理由是:____________
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O![]() VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是
VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是

A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示:


下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度,40 min时升高温度
D. 30 min时减小压强,40 min时升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是 ( )
A. 1 mol CO2 的质量为44 g/mol
B. 硝酸的摩尔质量63g
C. 2gH2所含原子数目为2mol
D. 0.5molNa2SO4溶于水中,所得溶液中Na+个数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下图是金属镁和卤素单质(X2)反应的能量变化示意图。
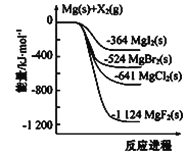
写出MgBr2(s)与Cl2(g)生成MgCl(s)和Br2(l)的热化学方程式______________________________。
(2)甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。当电池中有2mol e-发生转移时,左右两侧溶液的质量之差为______g(假设反应物耗尽,忽略气体的溶解)。

(3)250mLK2SO4和CuSO4的混合溶液中c(SO42-)=0. 5mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况下)。假定电解后溶液体积仍为250mL,写出阴极电极反应式______________原混合溶液中c(K+)=__________________
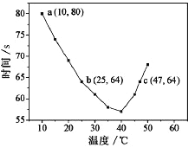
(4)NaHSO3溶液在不同温度下均可被过量![]() KIO3氧化。将浓度均为0.020mol/L
KIO3氧化。将浓度均为0.020mol/L![]() NaHSO3溶液(含少量淀粉)10ml
NaHSO3溶液(含少量淀粉)10ml![]() 、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的
、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的![]() NaHSO3反应速率为________________
NaHSO3反应速率为________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1.5NA个H3PO4的摩尔质量为____,含氧原子的物质的量为____。
(2)a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为_____。
(3)25.2g Na2RO3含Na+0.4mol,则Na2RO3的摩尔质量为___,R的相对原子质量为__。含R的质量为1.6g的Na2RO3,其物质的量为___。
(4)相同条件下,比较下列物质中氢原子数目多少(填“>”“<”或“=”):
①4.9g H2SO4____3.6g H2O ②1.6L CH4___2.4L H2
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中发生反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法正确的是( )

A. 323 K时,缩小容器体积可提高SiHCl3的转化率
B. a、b点对应的反应速率大小关系:v(a)<v(b)
C. 343 K时,上述反应的化学平衡常数约为0.02
D. 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com