
科目: 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极__________________________ ;
②图中X溶液是_______________,
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。

①甲池中OH-移向__________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________。
③乙池中总反应的离子方程式___________________。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的C(H+)是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
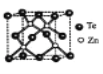
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(1)上述实验流程中加入过量的Na2CO3的目的是____。
(2)按此实验方案得到的溶液3中肯定含有___(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___,之后若要获得固体NaNO3需进行的实验操作是___(填操作名称)。
(3)下列是某学生设计NaCl、Na2SO4、NaNO3混合物中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验__离子,应加入过量的___,检验是否加入过量的方法___。
②将所得混合物过滤,然后在溶液中加入___试剂检验另一离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.5.85g氯化钠所含的离子数为0.1NA
B.2.8gN2中含有共用电子对的数目为0.1NA
C.0.1molF2中含有共价键的数目为0.2NA
D.0.1molH2与Cl2的混合气体充分反应后体系中含有共价键数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H=akJ/mol
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ/mol、+52.3kJ/mol。则a=___________。
II.乙烷氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
反应温度/℃ | 乙烷转化率/% | 乙烯选择性/% | 产率/% |
750 | 80.5 | 62.9 | 50.6 |
800 | 85.6 | 64.5 | 55.2 |
850 | 92.2 | 63.2 | 58.3 |
900 | 97.6 | 59.0 | 57.6 |
(2)①反应的平衡常数表达式为K=___________,K(750℃)___________K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是________________。
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。

(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________,n=___________。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为__________,这种电池工作过程中没有CO2排放,原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某有机物由C、H、O三种元素组成,球棍模型如图所示:
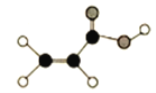
①含有的官能团名称是_______;
②写出此有机物与金属钠反应的化学方程式_______。
(2)四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。

①可以鉴别甲和乙的试剂为_________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
②上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是_________(填名称),
③乙和丁的物质的量共1.5mol,完全燃烧需要的氧气的物质的量是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com