
科目: 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
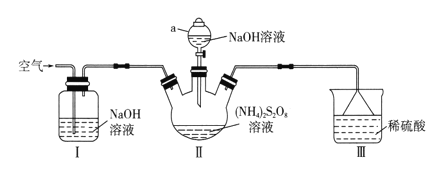
已知:①(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A. -870.3 kJ/mol B. -571.6 kJ/mol
C. +787.0 kJ/mol D. -488.3 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列的是____。
①0.5 mol氨气 ②标准状况下22.4 L氦气 ③4℃时9 mL水 ④0.2 mol磷酸钠
(2)某双原子分子构成的气体,其摩尔质量为Mg/mol,该气体质量为mg,阿伏加德罗常数为NA,则:
①该气体的物质的量为____mol
②该气体在标准状况下的体积为____L
③该气体在标准状况下的密度为____g/L
④该气体所含原子总数为____个
⑤该气体的一个分子的质量为____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷是生物体中不可缺少的元素,它们能形成多种化合物。

(1)基态氮原子的价层电子排布图为___________。
(2)NF3的键角小于NH3的原因是__________________。
(3)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构。
①该化合物的分子式为______________,分子中硫原子的杂化轨道类型为____________________。
②磷的第一电离能大于硫的原因是________________________。
(4)PCl5中P—Cl键长有198pm和206 pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,阴离子的化学式为_________________。
(5)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为_______________;已知该晶胞中距离最近的两个磷原子的核间距离为d nm,则该晶体密度为______g·cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
(6)某直链多磷酸钠的阴离子呈如图3所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,见光易分解,在潮湿空气中易被氧化,难溶于水。
(1)实验室保存新制CuCl晶体的方法是_________________。
(2)已知:Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
2CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则反应4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=____kJ/mol。
(3)利用CuCl难溶于水的性质,可以除去废水中的Cl-。向含Cl-的废水中同时加入Cu和CuSO4,溶液中平衡时相关离子浓度关系如图所示。[已知:pc(离子)=-lgc(离子)]

①除去废水中Cl-的离子方程式为_________________。
②Ksp(CuCl)=___________。
③已知:Cu+Cu2+![]() 2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
(4)T℃时,用H2还原CuCl制备活性铜:H2(g)+2CuCl(s)![]() 2Cu(s)+2HCl(g),达到平衡时,H2的转化率(
2Cu(s)+2HCl(g),达到平衡时,H2的转化率(![]() )为80%。反应速率v=v正-v逆=
)为80%。反应速率v=v正-v逆=![]() ,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当
,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当![]() =60%时,
=60%时,![]() =________(保留1位小数)。
=________(保留1位小数)。
(5)CuCl溶于浓氨水的反应原理为CuCl+2NH3·H2O![]() [Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
[Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料
B. 石油分馏得到的汽油、煤油、柴油等都有固定的熔沸点
C. 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等)
D. 天然气和沼气的主要成分是乙烯,它们都属于不可再生能源
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. Ka(HA)的数量级为10-5
B. 当NaOH溶液与HB混合至中性时:c(B-)<c(HB)
C. 等浓度的NaA、NaB溶液中,水的电离程度:NaA<NaB
D. 等浓度的HB和NaA的混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。电池工作时电极上发生的反应为:
![]()
下列关于该电池的叙述正确的是

A. 电池工作时,是将化学能转化为电能
B. 电池工作时,电解质溶液中I-和I3-浓度不断减少
C. 透明导电玻璃上的电势比镀Pt导电玻璃上的电势高
D. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com