
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型非金属材料,室温下能缓慢水解。可由铝粉在氮气氛围中1700℃合成,产物为白色到灰蓝色粉末。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。请回答:
(一)制备AlN

(1)按气流由左向右的方向,上述装置的正确连接顺序为j→__________________→i(填仪器接口字母编号)。
(2)实验时,以空气为原料制备AlN。装置A中还原铁粉的作用为________________,装置B中试剂X为_____________________。
(二)测定产品纯度
取m g的产品,用以下装置测定产品中AlN的纯度(夹持装置已略去)。
已知:AlN + NaOH + H2O = NaAlO2 + NH3↑
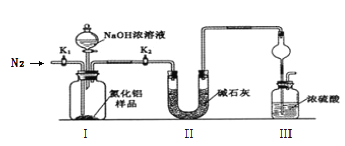
(3)完成以下实验步骤:组装好实验装置,首先_________________________________,加入实验药品。接下来的实验操作是关闭______________________________并打开______________,再打开分液漏斗活塞加入足量NaOH浓溶液后关闭,至不再产生气体。再______________,通入氮气一段时间,测定装置III反应前后的质量变化为n g。
(4)实验结束后,计算产品中AlN的纯度为___________﹪(用含m、n的代数式表示)。
(5)上述实验的设计仍然存在缺陷,你认为可能的缺陷及会导致的测定结果____________(用 “偏高”、“偏低”描述)如何______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组的同学按下列实验流程制备Na2CO3,设计的部分装置如图所示。

下列叙述正确的是
A. 若X为浓氨水,Y为生石灰,则可用装置甲制取NH3
B. 反应①可在装置乙中发生,反应②可在装置丁中发生
C. 可用装置丙进行过滤操作
D. 将母液蒸干灼烧后可得到NH4Cl固体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分:
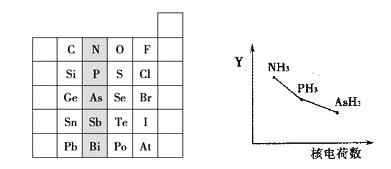
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,在我国部分海域中出现了大面积的“赤潮”,给当地渔业造成了重大损失,赤潮直接威胁着人类生存的环境,已经成为我国目前最主要的海洋灾害之一。下列关于赤潮发生原因的叙述正确的是
A. 含氯化合物直接排入大海,引起赤潮的发生。
B. 赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果。
C. 含氮、磷的大量污水直接排入大海,导致某些浮游生物爆发性繁殖是赤潮发生的直接原因。
D. 空气中二氧化碳浓度升高,导致海洋温度升高,引起了赤潮的发生。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A. 海水中含有钾元素,只需经过物理变化能得到钾单质
B. 海水蒸发制海盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na
D. 利用潮汐发电是将化学能转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。B、C中均加有10mL 1mol/L的NaBr溶液。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量液体放入D中,取下试管并振荡。
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的化学方程式是____________________________________________。
(3)过程Ⅳ中出现的现象是________,由此可证明氧化性较强的是________(填“Br2”或“I2”)。
(4)设计过程Ⅲ的目的是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题,工业上常用天然气还原法处理氮的氧化物。
(1) CH4催化还原NO 、NO2的热化学方程式如下:
序号 | 热化学方程式 |
① | 4NO2(g)+ CH4 (g) |
② | 4NO(g)+ CH4 (g) |
则4NO(g)![]() N2(g) +2NO2(g)的ΔH=___________________。
N2(g) +2NO2(g)的ΔH=___________________。
(2)T1℃时,在一密闭容器中发生反应4NO(g)![]() N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
序号 | c(NO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.10 | 4.00×10-9 |
② | 0.20 | 6.40×10-8 |
③ | 0.30 | 3.24×10-7 |
则n=_____________,k正=________________mol-3·L3·S-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将_______________(填“增大”、“减小”或“不变”)。
(3)利用测压法在刚性密闭容器中研究T2℃时4NO(g)![]() N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 |
压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
①20 min时,NO的转化率α =____________﹪。
②T2℃时4NO(g)![]() N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,体积均为100 mL、浓度均为0.1 mol·L-1的两种一元碱MOH和ROH的溶液中,分别通入HCl气体,lg[c(OH-)/c(H+)]随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)

A. a点由水电离产生的c(H+)和c(OH-)的乘积=1×10-26
B. b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-)
C. c点溶液溶液的pH=7,且所含溶质为ROH和RCl
D. 碱性:MOH>ROH,且MOH是强碱,ROH是弱碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com