
科目: 来源: 题型:
【题目】I:在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
II:等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
III:已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11,含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________,常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,则该样品中c(H+)=_____________,该样品放置一段时间后,酸性略有增强,其原因可能是________________________________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
查看答案和解析>>
科目: 来源: 题型:
【题目】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) ![]() H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g) ![]() H2 = -41 kJmol-1
H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) ![]() H3 = -660kJmol-1
H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。

实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管 B.酸式棕色滴定管 C.碱式无色滴定管 D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/ kg。
查看答案和解析>>
科目: 来源: 题型:
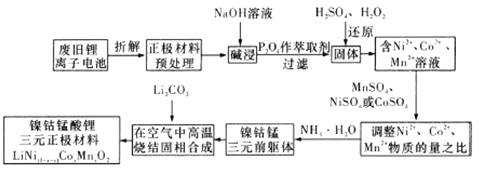
【题目】镍钴锰酸锂电池是一种高功率动力电池。下列流程采用废旧锂离子电池正极材料(正极一般以铝箔作为基底,两侧均匀涂覆正极材料,正极材料包括一定配比的正极活性物质,如钴酸锂、磷酸铁锂、锰酸锂和三元材料等)制备镍钴锰酸锂三元正极材料(![]() )
)![]() )
)
回答下列问题:
(1)写出正极碱浸过程中的离子方程式:________________;能够提高碱浸效率的方法有____________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_________________。
(3)![]() 中
中![]() 元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是___________________。
(5)已知溶液中![]() 的浓度为
的浓度为![]() ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生![]() 沉淀,列式计算
沉淀,列式计算![]() 沉淀完全时溶液的
沉淀完全时溶液的![]() ______________________(已知离子沉淀完全时
______________________(已知离子沉淀完全时![]() ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是( )
A. 醋酸溶于水:CH3COOH===CH3COO-+H+
B. NaHSO4溶于水:NaHSO4===Na++HSO4-
C. 碳酸氢钠溶于水:NaHCO3![]() HCO
HCO![]() +Na+
+Na+
D. 次氯酸溶于水:HClO![]() H++ClO-
H++ClO-
查看答案和解析>>
科目: 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com