
科目: 来源: 题型:
【题目】标准状况下有:①6.72LCH4;②3.01×1023个氯化氢分子;③13.6gH2S分子;④0.2molNH3,下列对四种气体的关系从小到大表达正确的是( )
A.体积:④①②③B.分子数:①④③②
C.质量:④①③②D.氢原子个数:②④①③
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下:Ca3(PO4)2+SiO2+C![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目____________.
_____Ca3(PO4)2+_____SiO2+_____C![]() _____CaSiO3+_____P4↑+_____CO↑
_____CaSiO3+_____P4↑+_____CO↑
(2)该反应中被还原的元素是_____,氧化产物是_____.
(3)每消耗24.0g碳时,有_____个电子发生转移,生成P4_____g.
(4)反应所得混合气体,折算成标况下,其气体密度为_____g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式_____.
(6)为除去废水中的NH4+,向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为_____L(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是________。
(3)操作Ⅰ的名称为____,简述利用“操作Ⅰ”的装置洗涤难溶物的实验操作________。
(4)化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1︰2反应可生成Cl-和一种阳离子________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是________。
(5)常温时N2H4·H2O(水合肼)在碱性条件下能还原(4)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到________g的单质Ag。
(6)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为________,负极的产物有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110 ℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77 ℃,沸点:137 ℃,S2Cl2遇水剧烈反应。

(1)S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,写出该反应的化学方程式__________________________________。
(2)B中所装试剂名称为__________________________。
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为_________。
(4)装置E的作用是____________________________________________,写出E中发生的氧化还原反应的化学方程式_________________________。
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。生成二氯化二硫的反应为________ (填“放热”或“吸热”)反应。
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,现需对该装置进行改进,则改进的方法为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列各组物质:
①红磷、白磷 ②![]() 、
、![]() ③
③![]() 、
、![]() ④
④![]() 、
、![]() ⑤
⑤![]() 、
、![]() ⑥
⑥![]() 、
、![]()
其中属于同位素的是______________,属于同素异形体的是___________,属于同种元素的不同种微粒的是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的简化电子排布式为________。
(2)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是_____(填化学式,写一种)。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42—中S原子的杂化方式为____,用价层电子对互斥理论解释SO32—的键角比SO42—键角小的原因___________________________________________________。
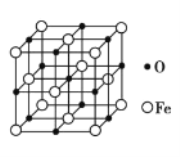
(4)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为____。

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为____;Fe2+与O2—的最短核间距为____pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如图:

(1)写出反应I的离子方程式________________________。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有__________。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3 mol·L-1)可产生FeCO3沉淀时的最小Fe2+浓度是_________。(已知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式________________________________________。
(5)固体物质A的成分是_________(写名称),溶液B中所含溶质是__________(写化学式)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红褐色的Fe(OH)3固体,写出相关的化学方程式:_____________________________________________。
(7)本流程中可实现循环使用的物质除了水外,还有____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[2012·课标全国卷](9分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是____________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com