
科目: 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品。
(1)反应化学方程式为:___。
(2)电解饱和食盐水时,___极区附近溶液pH变大。
(3)取阴极区溶液作系列实验,下列结论中错误的是___。(填字母)
A.滴加石蕊试剂,溶液呈红色
B.滴加氯化镁溶液,有白色沉淀产生
C.加入石灰石,有气泡产生
D.先加足量硝酸,再滴加硝酸银溶液,若产生沉淀说明溶液中含有氯离子
(4)电解饱和食盐水一段时间后,想要让溶液恢复电解前的状态,应往溶液中加入(或通入)一定量的___(填字母)。
A.NaCl固体 B.NaCl溶液 C.HCl气体 D.盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】四氢噻吩(![]() )是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是
A. 不能在O2中燃烧B. ![]() 与Br2的加成产物只有一种
与Br2的加成产物只有一种
C. ![]() 能使酸性KMnO4溶液褪色D. 生成1 mol C4H9SH至少需要2molH2
能使酸性KMnO4溶液褪色D. 生成1 mol C4H9SH至少需要2molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B. 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C. 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D. 压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
D. 将水加热,pH不变,KW增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某化合物H的合成路线如下:
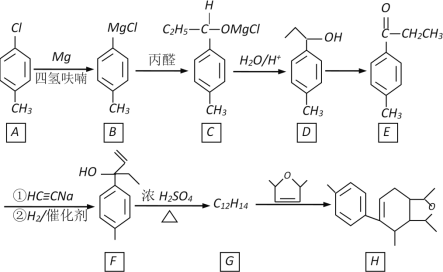
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa
(1)A的化学名称是________________________,B→C的反应类型是________________
(2)D→E的反应试剂、条件是________,F中不含氧官能团名称是____________
(3)H的分子式是___________________
(4)F→G的化学方程式是________________
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是___________(写一种)
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
(6)依据上述题目信息,写出用乙醛和乙炔为原料,制备化合物![]() 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com