
科目: 来源: 题型:
【题目】—种新型可逆电池的工作原理如图所示,放电时总反应为Al+3Cn(AlCl4)+4AlCl4-![]() Al2Cl7-+3Cn- (Cn代表石墨),下列说法正确的是
Al2Cl7-+3Cn- (Cn代表石墨),下列说法正确的是

A. 充电时,石墨电极作阴极
B. 充电时,熔融盐中的A1C14-向右移动
C. 放电时,负极反应为:2A1 - 6e-+ 7C1-= A12C17-
D. 放电时,若电路中转移3 mol电子,则有1 mol Cn(A1C14)被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

则,A的化合价__B的化合价(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

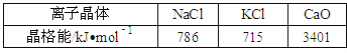
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:__.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________________________.
(4)某配合物的分子结构如图所示,则N原子的杂化方式为__;基态Ni原子的电子排布式__.
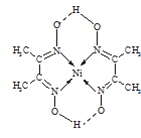
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:

完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是一种轻金属,被称为金属界的“万金油”,应用范围极为广阔。含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
完成下列填空:
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5 nm的致密氧化膜,写出除去氧化膜的一种方法____________________(用方程式表示)。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因_____________________(用方程式说明);写出Al(OH)3的电离方程式________________。
(3)明矾(KAl(SO4)2·12H2O)的水溶液呈_______性(选填“酸”、“碱”或“中”),溶液中离子浓度大小顺序为_____________________。将明矾溶液与小苏打溶液混合会产生白色沉淀和气体,请用平衡移动原理解释该现象。_______________________________________
(4)碳热还原氯化法从铝土矿中炼铝具有步骤简单、原料利用率高等优点,其原理如下:
Ⅰ. Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ. 3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
① 写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
② 写出反应Ⅱ达到平衡状态的一个标志_________________________________;
结合反应Ⅰ、Ⅱ进行分析,AlCl3在炼铝过程中的作用可以看作______________。
③ 将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总质量增加了27.6g,则AlCl的化学反应速率为_________ mol/(L·min)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中科大研制出Ni-Mo-O纳米棒复合催化剂,利用其进行尿素电解,可实现富尿素废水的净化,同时低能耗制得H2。总反应为:CO(NH2)2 + H2O![]() 3H2↑ + N2↑ + CO2↑。
3H2↑ + N2↑ + CO2↑。
完成下列填空:
(1)上述反应涉及的元素中,质子数最多的原子其核外电子排布式是___________;写出同周期元素的原子半径大小关系____________(用元素符号表示)。
(2)上述反应物与产物中,属于电解质的是_____________(填化学式);写出可以冷冻待移植器官的物质的电子式_______________。
(3)C与N的非金属性强弱顺序为____________(用元素符号表示),用一个化学方程式进行证明________________。
(4)已知常压下,二氧化硅熔点为1723℃,而干冰在-78.5℃时就升华,解释二者性质差异大的原因___________________。
(5)电解富尿素废水时,氢气在____极产生。若转移0.3 mol电子,两极产生的气体共__________L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示

(1)溴化钠晶体比氯化钠晶体晶格能________(填“大”或“小”),主要原因是_____。
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是_________________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是________。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是我国化工专家侯德榜发明的联合制碱法简要流程:

关于此流程说法正确的是
A. 副产品Y是NH4HCO3B. 向母液中通入的气体X是CO2
C. 循环II是为了提高食盐的利用率D. 析出NaHCO3后的母液中只含NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素A的一价阴离子的电子层结构与氩原子相同,元素B的二价阳离子的电子层结构与氖原子相同。请回答:
(1)元素A离子的结构示意图为___,A的单质呈___色,检验该物质的方法是___。
(2)由A、B形成的化合物的电子式是___。
(3)与A离子具有相同电子数的一种分子是___(填名称)。
(4)A的单质与Ca(OH)2反应的化学方程式___,该反应工业上的用途是___。
(5)蓝色石蕊试纸遇到A的水溶液现象是___,请你解释这个现象___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com