
科目: 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污
泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为__________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式______________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是____(选填编号),滴定终点现象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[c (H+)/c(OH-)]的关系如图所示(V=0时,

lg[c (H+)/c(OH-)]=-12)。下列说法正确的是( )
A. MOH的电离方程式为MOH![]() M++OH-
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数为(10/17)×10-9
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子合物J的合成路线如下:

已知:i、
ii、
(1)写出E的名称:_____________,由G生成H的反应类型为:______________。
(2)I中官能团名称:____________________。B→C的反应条件为:___________。
(3)由I可合成有机物K,K中含有3个六元环,写出I合成K的化学方程式:____________________________________________________。
(4)D→E反应的化学方程式:_____________________________。
(5)有机物L(C9H10O3)符合下列条件的同分异构体有______种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基
(6)结合上述流程中的信息,设计由![]() 制备
制备 的合成路线_____。合成路线流程图示例:
的合成路线_____。合成路线流程图示例:![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是




甲 乙 丙 丁
A. 图甲表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH
B. 图乙表示常温下0.100 0 mol·L-1醋酸溶液滴定20.00 mL0.100 0 mol·L-1 NaOH溶液的滴定曲线
C. 图丙表示反应CH4(g)+H2O (g)![]() CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
CO(g)+3H 2(g)的能量变化,使用催化剂可改变Eb﹣Ea的值
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率c>b>a
查看答案和解析>>
科目: 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
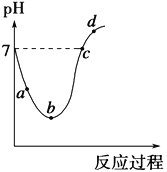
A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在方框中)。_________________
供选用的电解质溶液有:稀硫酸、硫酸铜溶液
供选用的电极材料有:锌片、铜片、铁片
电极材料及电极反应式:
负极材料:______________,电极反应式:___________________,
正极材料:______________,电极反应式:___________________,
电解质溶液:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_____(填元素符号),原子结构示意图为_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是:_____________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________,该化合物属于_____(填 “共价”或“离子”)化合物。
(4)表示①与H的化合物的化学式_________________,该化合物是由____________(填“极性”“非极性”)键形成的。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,由图中数据分析,反应物是____,t2时,N的浓度是_______________;若t2=1 min,从反应开始到t2 ,M的平均反应速率为_____________; 该反应的化学方程式为______;在反应达到化学平衡时,各组分的浓度保持______(填“相等”或“不变”)且_______(填“一定”或“不一定”相等,各物质的反应速率之比_______(填“一定”或“不一定”)等于化学计量数之比。

查看答案和解析>>
科目: 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
B. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com