
科目: 来源: 题型:
【题目】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(1)“O”点为什么不导电___________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是用于通过测定单位时间内产生气体的体积来测量反应速率的装置,下列说法中正确的是( )

A. 如果在分液漏斗中加入稀硫酸,在锥形瓶中加入纯锌比加入粗锌产生氢气速率快
B. 如果在分液漏斗中加入浓硫酸,在锥形瓶中加入粗锌比加入纯锌产生氢气快
C. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸比加入稀硫酸和少量硫酸铜产生氢气速率快
D. 在锥形瓶中加入纯锌,在分液漏斗中加入稀硫酸和少量硫酸铜比加入稀硫酸产生氢气速率快
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A. 制取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B. 冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
C. 制硝酸:N2、H2 ![]() NH3
NH3![]() NO
NO![]() 50%HNO3
50%HNO3 ![]() 浓HNO3
浓HNO3
D. 海带![]() 海带灰
海带灰![]()
![]() I2(aq)
I2(aq)![]() I2
I2
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是某药物中间体D的合成过程:
A(C6H6O)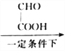 B
B![]()

![]()

(1)A的结构简式为_________________,A转化为B的反应类型是____________。
(2)D中含氧官能团的名称是__________。
(3)鉴别B、C可以用的试剂名称是______________。
(4)D在一定条件下与足量NaOH溶液反应的化学方程式是_________________。
(5)同时符合下到条件的D的所有同分异构体(不考虑立体异构)有________种。
①能与NaHCO3溶液反应产生气体;②苯环上只有2个取代基;③遇氯化铁溶液发生显色反应。其中核磁共振氢谱显示为5组峰,且峰面积比为3∶1∶2∶2∶1的同分异构体的结构简式是________________________________(写结构简式)。
(6)已知:
 +CH≡CH
+CH≡CH 
请设计合成路线以A和C2H2为原料合成![]() (无机试剂任选):____________。
(无机试剂任选):____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是重要的化工原料,用途非常广泛。
实验一:SO2可以抑制细菌滋生,具有防腐功效。某实验小组欲用下图所示装置测定某品牌葡萄酒中(葡萄酒中含有乙醇、有机酸等)的SO2含量。
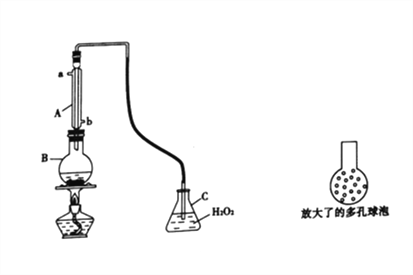
(1)仪器A的名称是________;使用该装置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,C中化学方程式为_________________________________________。
(3)将输入C装置中的导管顶端改成具有多孔的球泡(如图15所示)。可提高实验的准确度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH标准溶液滴定。
①用碱式滴定管量取0.09mol·L-1NaOH标准溶液前的一步操作是___________________________;
②用该方法测定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用现有的装置,提出改进的措施是_______________________________________________。
(5)利用C中的溶液,有很多实验方案测定葡萄酒中SO2的含量。现有0.1mol·L-1BaCl2溶液,实验器材不限,简述实验步骤:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为________。
(2)2-巯基烟酸( )水溶性优于2–巯基烟酸氧钒配合物(
)水溶性优于2–巯基烟酸氧钒配合物( )的原因是___________________________________________________________________。
)的原因是___________________________________________________________________。
(3)各原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)尿素(H2NCONH2)尿素分子中,原子杂化轨道类型有________,σ键与π键数目之比为________。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如左下图)和六方氮化硼(如右下图),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。左上图中原子坐标参数A为(0,0,0),D为(![]() ,
,![]() ,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(
,0),则E原子的坐标参数为________。X-射线衍射实验测得立方氮化硼晶胞边长为361.5pm,则立方氮化硼晶体中N与B的原子半径之和为________pm(![]() =1.732)。
=1.732)。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表这式为________pm。(已知正六边形面积为![]() a2,a为边长)
a2,a为边长)
查看答案和解析>>
科目: 来源: 题型:
【题目】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________(只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________。
(3)加入NaOH溶液的目的是调节溶液的pH,水解时通入水蒸气的目的是_______________________。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。用石墨作电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________,若电解液中不加入Cu(NO3)2,阴极反应式是______________________,这样做的主要缺点是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯是工业上重要的原料,是合成有机物的中间体。
2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0
2ClNO(g) △H<0
(1)在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1 ,则平衡后NO的转化率α1=_____________。其它条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”)。
(2)若使反应2NO(g)+Cl2(g)![]() 2ClNO(g) 的平衡常数增大,可采用的措施是___________。
2ClNO(g) 的平衡常数增大,可采用的措施是___________。
(3)将NO与Cl2按物质的量之比2∶1充入一绝热密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。
2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。

(4)在其他条件相同时,向五个恒温的密闭容器中分别充入1molCl2与2molNO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
容器编号 | 温度/℃ | 容器体积/L | 平衡时ClNO含量(占比) |
Ⅰ | T1 | 2 | 2/3 |
Ⅱ | T2=T1 | 3 | W2 |
Ⅲ | T3>T1 | V3 | 2/3 |
Ⅳ | T4 | V4 | W4 |
Ⅴ | T5 | V5 | W5 |
①V3________2 (填写“大于”、“小于”或“等于”);
②容器Ⅱ中化学平衡常数K=_________;
③容器Ⅳ、容器Ⅴ分别与容器Ⅰ相比实验条件不同,反应体系总压强随时间的变化如图所示。与容器Ⅰ相比,容器Ⅳ改变的实验条件是_____________________;容器Ⅴ与容器Ⅰ的体积不同,则容器Ⅴ中反应达到平衡时气体总压强(P )的范围是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com