
科目: 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:

(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为_______,反应达平衡时,c(H2)=______。
(2)判断该反应达到平衡的依据是______(填序号)。
①CO减少的速率和CO2减少的速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】根据物质结构相关知识,回答下列问题:
(1)在第三周期的元素中,第一电离能介于Mg与Cl之间的有_____种。
(2)碳元素与氮元素形成的某种晶体的晶胞如图所示,其中8个C原子位于立方体的顶点,4个C原子位于立方体的面心,4个N原子在立方体内。
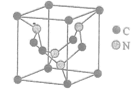
①已知该晶体硬度超过金刚石,其原因是_____。
②晶胞中C原子的杂化方式为_____。
③知该晶胞参数为a nm,阿伏加德罗常数用NA表示,则该晶体的密度为g·cm-3________
(3)大π键可表示为Πmn,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如![]() 的大π键可表示为Π66,则CO32-中的大π键可表示为______。
的大π键可表示为Π66,则CO32-中的大π键可表示为______。
(4)金属铬是一种极硬、耐腐蚀的银白色金属,其化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①基态铬原子的价电子排布式为_____。
②配离子[Cr(H2O)3(NH3)3]3+的结构可能有种______。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AIP的熔点为2000℃,其晶胞结构如下图所示。
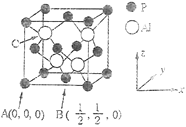
①C点的原子坐标为_____。
②AlP的晶胞中,Al原子位于P原子形成的正四面体空隙中,此空隙的填充率为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1).向纯碱溶液中滴入酚酞溶液,①观察到的现象是__________________,原因是_______(用离子方程式表示)。
②若微热溶液,观察到的现象是__________________,原因是____________________。
(2).在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
① 若加入AgNO3固体,c(I-)__________。
② 若加入更多的AgI固体,则c(Ag+)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
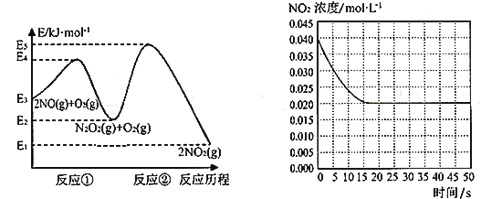
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2![]() 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
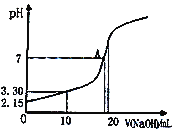
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:

(1)该反应的化学方程式是________________________。
(2)反应起始至t,Y的平均反应速率是__________________。
(3)X的转化率是_________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

(1)“O”点导电能力为0的理由是____________________________
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为__________________________。
(3)a、b、c三点处,电离程度最大的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列物质的溶液在蒸发皿中加热蒸干并灼烧(400℃),可以得到该物质的固体的是( )
A. AlCl3 B. NaHCO3
C. MgSO4 D. KMnO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com